서 론
조류인플루엔자 바이러스(avian influenza virus; AIV)는 Orthomyxoviridae 과(family)에 속하는 단일 가닥 RNA(single-stranded RNA) 핵산을 가지는 바이러스로서 8개의 RNA 분절 유전자(polymerase basic protein 2(PB2), polymerase basic protein 1(PB1), polymerase acidic protein(PA), hemagglutinin(HA), nucleoprotein(NP), neuraminidase(NA), matrix(M), nonstructural protein(NS))를 가지고 있다(Webster et al., 1992). 8개의 RNA 분절 유전자들은 바이러스주에 따라 차이는 있지만 최소 10개에서 최대 17개의 단백질을 암호화하는 것으로 알려져 있다(Vasin et al., 2014; Swayne et al., 2020). 이들 발현 단백질중 바이러스 외피막에 존재하는 HA와 NA의 항원성에 따라 AIV는 각각 16종(H1~H16)의 HA 아형(subtype)과 9종(N1~N9) NA 아형으로 구분된다(Fouchier et al., 2005; Swayne et al., 2020). AIV는 야생조류 및 가금류 등 다양한 조류에 감염할 수 있지만 감염하는 조류에 따라 병원성이 다양하게 나타난다. 닭에서는 감염 닭의 75% 이상 폐사를 유발하는 고병원성 AIV(highly pathogenic AIV; HPAIV)와 75% 미만의 치사율을 보이는 저병원성 AIV(low pathogenic AIV; LPAIV) 감염으로 구분된다(OIE, 2012). HPAIV는 HA 단백질의 분절부위(cleavage site)가 염기성 아미노산이 반복되는 패턴을 보이는 특징을 가지고 있으며 현재까지는 H5 또는 H7 아형에 속하는 바이러스 중 일부만 이러한 특징을 가지고 있는 것으로 알려져 있다(Senne et al., 1996; Kida et al., 2021). AIV 중 일부 아형들은 사람에 감염하기도 하며 사망을 유발할 정도로 심각한 병원성이 나타나기도 한다(Class et al., 1998; Shortridge et al., 1998; Peiris et al., 1999; Fouchier et al., 2004; Gao et al., 2013; Chen et al., 2015). 사람감염을 일으키는 아형은 주로 H5 및 H7 아형으로서 H5N1, H5N6, H5N8, H7N2, H7N3, H7N7, H7N9 등이 있으며 이중 H5N1, H5N6 및 H7N9 등은 사람감염시 40% 이상의 높은 치사율을 보이기도 한다(Li et al., 2019; Shi et al., 2023).
H11 아형의 AIV가 사람에 감염된 사례는 현재까지 확인되지 않았으나 혈청검사결과 야생조류 관련 종사자들에서 H11아형에 대한 항체가 확인된 바 있고(Gill et al., 2006) 일부 국가에서는 가금사육 관련 종사자들에서도 H11 아형에 대한 항체가 검출되는 것(Kayali et al., 2011)으로 보아 사람감염 가능성도 있을 것으로 추정되고 있다.
국내에서도 H11 아형의 AIV가 분리 보고된 바 있다(Kang et al., 2010; Lee et al., 2017). 본 연구에서는 H11 아형중 국내에서는 아직 보고되지 않은 H11N3 아형을 포함하여 최근에 분리된 H11 아형의 AIV를 대상으로 유전자 전체 염기서열을 분석하여 그 특성과 사람 감염 가능성 등을 알아보고자 실시하였다.
재료 및 방법
바이러스 분리 및 증식은 AIV 항체 음성인 9~11일령 계태아 종란(chicken embryo, 성민축산, 한국)을 이용하여 실시하였다. 즉, 채취한 야생조류 분변을 항생제(penicillin 100 unit/μL 및 streptomycin 100 mg/μL)가 첨가된 phosphate-buffered saline(PBS)에 혼합하여 충분히 섞어준 후 혼합물은 3,000 rpm에 10분간 원심분리하여 상층액을 0.45 μm 필터(Millex® syringe-driven filters, Merck Millipore, Ireland)로 여과한 후 여과액을 9~11 일령 계태아 종란의 요막강(allantoic cavity) 내로 접종한 후 37°C에서 4~5일 간 배양하였다. 배양액에서의 AIV 유무는 혈구응집반응(OIE, 2012)을 실시하여 양성시료에 대하여 AIV 공통 항원인 M 단백질 유전자를 검출하는 real-time reverse transcription polymerase chain reaction(rRT-PCR) 상용 키트(AIV M qRT-PCR(Ver 2.1), Median Diagnostics, Korea)를 이용하여 확인하였다.
분리된 AIV의 아형 확인은 기 보고된 아형 특이 primer 및 probe를 이용한 rRT-PCR으로 확인하였다(Hoffmann et al., 2016). 바이러스가 분리된 분변의 조류 종(species) 동정은 채취 분변으로부터 핵산 추출키트(Maxwell® RSC Viral TNA, Promega, USA)와 핵산 자동 추출기기(Maxwell RSC48, Promega, USA)를 이용하여 genomic DNA를 추출한 후 cytochrome oxidase I(COI) 유전자 일부를 증폭하여 염기서열을 분석하는 방법으로 실시하였다(Lee et al., 2010).
바이러스 염기서열 분석은 AIV를 감염시킨 계태아 요막강으로부터 바이러스 RNA를 추출하여 8개의 유전자 분절(segment) 전체를 각각 증폭하여 실시하였다. 즉, AIV 감염 요막강액에서 RNA 추출키트(Maxwell® RSC simplyRNA Tissue, Promega, USA)와 핵산 자동 추출기기(Maxwell RSC48, Promega, USA)를 이용하여 바이러스 RNA를 추출한 후 기 보고된 AIV의 각각 유전자 분절 특이 primer를 이용한 reverse transcription polymerase chain reaction(RT-PCR) 방법(Hoffmann et al., 2001)으로 각각의 유전자 분절을 증폭하였다.
증폭된 RT-PCR 산물을 유전자 염기서열 분석 전문회사(GnCBIO Co., Daejeon, Korea)에 의뢰하여 염기서열을 분석하였다. 염기서열 분석 결과는 Molecular evolutionary genetics analysis(MEGA) version 7 software(http://megasoftware.net/)와 MegAlign program(DNASTAR Inc, USA)의 Clustal W Method를 이용하여 분석하였다. 염기서열의 계통유전학적 분석(phylogenetic analysis)은 MEGA 7 software를 이용하여 neighbor-joining method로 1,000 bootstrap replicates로 실시하였다. 본 연구 분석에 활용된 AIV 유전자 정보는 NCBI Influenza virus Resource(https://www.ncbi.nlm.nih.gov/genbank/)와 GISAID(http://www.gisaid.org)를 통하여 확보한 유전자 정보들을 분석에 사용하였다.
결 과
본 연구의 유전자 분석에 사용된 바이러스 현황은 Table 1과 같다. 2012년에 분리된 1주를 비롯하여 2014년 1주, 2016년 1주, 2017년 2주 및 2018년에 분리된 1주 등 총 6주를 대상으로 8개의 전체 유전자(PB2, PB1, PA, HA, NP, NA, M, NS)를 분석하였다. 바이러스 아형은 H11N3 아형이 2주, H11N9이 4주이었다. 분리된 분변을 대상으로 조류종을 동정한 결과 3주는 조류종을 확인할 수 없었고 2주는 청둥오리(Anas platyrhynchos)에서 1주는 큰기러기(Anser fabalis)에서 각각 분리된 바이러스들이었다.
HA 유전자중 단백질 암호화 부위인 1,698개 nucleotide(nt)를 대상으로 6주 분리주간 비교분석한 결과 상동성은 94.76~99.82%이었다. HA 유전자의 계통유전학적 분석을 실시한 결과 6주 모두 유라시안 계열(lineage)의 바이러스로 분류되었으며 북미 계열로 분류되는 바이러스는 확인되지 않았다(Fig. 1). 국내 분리주들은 유라시안 계열로 분류되었으나 그 중에서 두개의 sublineage로 다시 구분되었다. 즉, 2018년에 큰기러기에서 분리된 H11N9 바이러스(A/bean goose/Korea/KNU18-88/2018(H11N9))는 2016년과 2017년 국내에서 분리된 동일한 아형 바이러스인 H11N9 바이러스 3주와는 다른 sublineage로 분류되었고, 오히러 2014년 중국 후베이성 야생조류에서 분리된 동일 아형 바이러스인 H11N9(A/wild bird/Hubei/89/2014(H11N9)) 바이러스와 2019년 방글라데쉬 오리에서 분리된 N 아형이 다른 바이러스인 H11N3(A/duck/Bangladesh/38827/2019(H11N3))와 같은 sublineage로 구분되었다(Fig. 1).

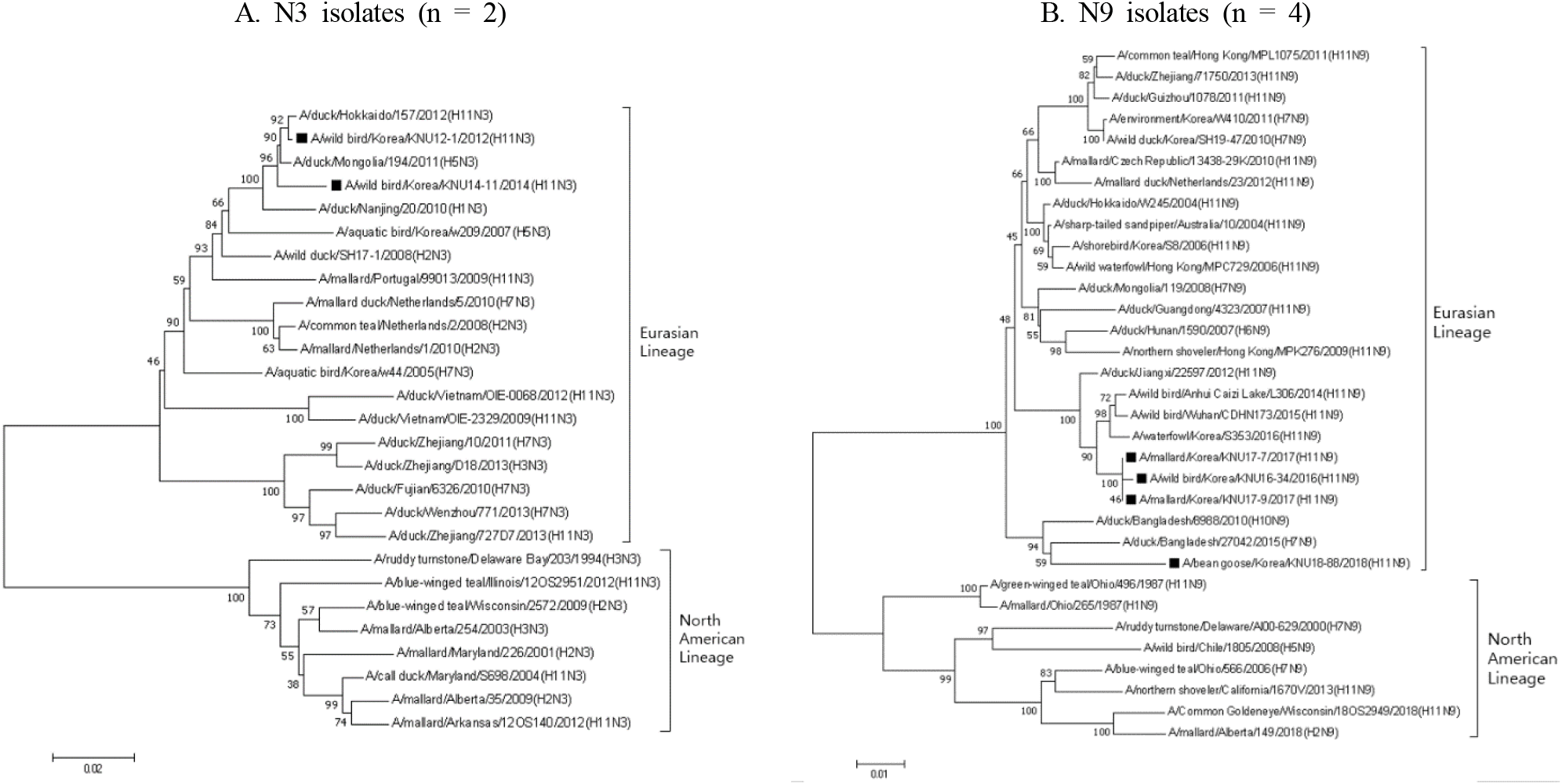
H11N3(n = 2) 아형 2주와 H11N9(n = 4) 아형 4주를 대상으로 각각 동일한 NA 아형 바이러스들과 비교하여 계통유전학적 분석을 실시하였다. N3 아형으로 분류된 2주간의 NA 유전자의 nt 상동성은 98.51%이었고 N9 아형으로 분류된 4주간의 NA 유전자 nt 상동성은 94.55~100%이었다. N3 아형 2주는 모두 유라시안 계열(lineage)의 바이러스로 분류되었으며 유라시안 계열 중에서도 동일한 sublineage로 분류되었다(Fig. 2A). N9 아형 4주의 경우에도 모두 유라시안 계열의 바이러스로 분류되었으나 그 중에서 두개의 sublineage로 다시 구분되었다. 즉, 2018년에 분리된 H11N9 바이러스(A/bean goose/Korea/KNU18-88/2018(H11N9))는 다른 바이러스와 별개의 sublineage로 구분되었으며 2015년 방글라데쉬 오리에서 분리된 H7N9 바이러스와 가장 가까운 근연관계를 보여주었다(Fig. 2B).
PB2 유전자의 계통유전학적 분석결과 국내분리주 모두는 유라시안계열로 분류되었고 북미계열로 분류되는 바이러스는 확인되지 않았다. 유라시안 계열내에서도 국내 분리주들은 2개의 sublineage로 구분되었는데 2012년 분리주인 A/ wild bird/Korea/KNU12-1/2012(H11N3)와 2014년 분리주인 A/wild bird/Korea/KNU14-11/2014(H11N3)는 같은 sublineage로 분류되었으나 2016년 이후 분리주들은 모두 다른 sublineage로 분류되었다(Fig. 3A).
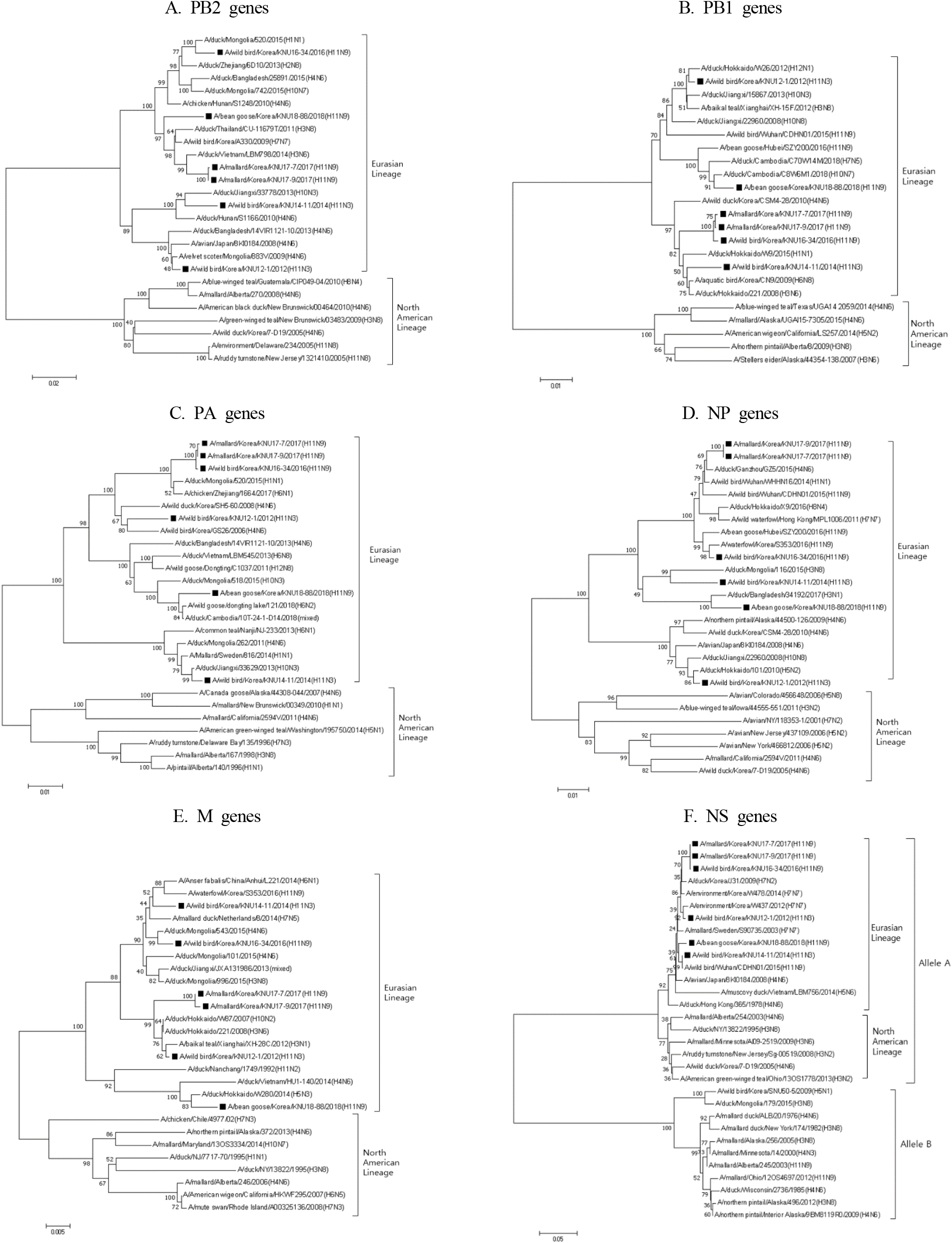
PB1 유전자의 경우에도 국내분리주 모두는 유라시안계열로 분류되었고 그 안에서 두개의 sublineage로 다시 구분되었다. 즉, A/wild bird/Korea/KNU16-34/2016(H11N9), A/ mallard/Korea/KNU17-7/2017(H11N9), A/mallard/Korea/KNU17-9/2017(H11N9) 및 A/wild bird/Korea/KNU14-11/2014(H11N3)는 일본 오리에서 분리된 A/duck/Hokkaido/221/2008(H3N6)와 가까운 근연관계를 보이면서 같은 sublineage로 분류되었고 나머지 2개주와는 별개의 sublineage로 구분되었다(Fig. 3B).
PA 유전자의 경우에도 국내 분리주 모두는 유라시안 계열로 분류되었으며 계열내에서는 다시 두개의 큰 sublineage로 구분되었다. 즉, 6개 분리주 중 2014년 분리주인 A/wild bird/Korea/KNU14-11/2014(H11N3)만 별도의 sublineage로 분류되었고 나머지 5개 분리주는 다른 sublineage로 구분되었으나 이들은 동일 sublineage 내에서도 또 서로 구분되는 양상을 보였다. 그러나 2016년 및 2017년 분리 3주는 2015년 몽골(Mongolia) 오리에서 분리된 바이러스인 A/duck/ Mongolia/520/2015(H1N1)와 가까운 근연관계를 보이면서 그 이전의 바이러스와는 다른 별개의 동일한 부류로 구분되었다(Fig. 3C).
NP 유전자의 경우에도 국내 분리주 모두 유라시안 계열로 분류되었다. 그러나 유라시안 계열내에서는 두개의 sublineage로 구분되었는데 2012년 분리주인 A/wild bird/ Korea/KNU12-1/2012(H11N3)와 나머지 분리주 5개주는 별도의 sublineage로 구분되었다(Fig. 3D).
M 유전자의 계통학적 분석 결과에서도 국내 분리주 모두는 유라시안 계열의 바이러스로 분리되었고 유라시안 계열내에서도 2018년 분리주인 A/bean goose/Korea/KNU18-88/ 2018(H11N9)는 다른 바이러스와 다른 별개의 sublineage로 구분되었다(Fig. 3E).
NS 유전자의 계통유전학적 분석결과 국내 분리주 모두는 allele B와는 별개로 구분되는 allele A에 속하였으며 allele A 중에서도 모두 유라시안 계열로 분류되었다(Fig. 3F).
분석된 염기서열을 토대로 HA 단백질 중 HA1 단백질의 C-말단 부위와 HA2 단백질의 N-말단 부위가 분절되는 cleavage site의 아미노산 배열을 분석한 결과, 국내 분리주 모두는 PAIASR/GLF의 아미노산 배열을 가지는 것으로 나타나 저병원성 바이러스 특성을 보여주었다(Table 2).
HA 단백질 중 HA receptor binding site(RBS)의 아미노산 배열은 숙주세포의 sialic acid receptor 결합 특성과 관련이 많다. 이중 숙주세포 결합과 관련성이 높은 부위의 아미노산 배열을 분석하였다. 즉, HA 단백질의 138, 190, 225, 226 및 228번째 아미노산을 분석하여 A138S, E190D, G225D, Q226L, G228S의 치환 여부를 확인한 결과, 국내 분리주 모두는 이들 아미노산 치환이 관찰되지 않아 사람보다 조류 감염 특성이 더 높을 것으로 추정되었다(Table 2).
NA 단백질도 숙주 감염 특성이나 사람 감염 가능성 등과 관련이 있는 것으로 알려져 있다(Matrosovich et al., 1999). NA 단백질의 줄기부위(stalk region)에서 아미노산 결손 유무를 분석한 결과 국내 분리주 모두는 이 부위에서의 아미노산 결손은 확인되지 않았다. NA 단백질 중 항바이러스제인 oseltamivir과 zanamivir에 대한 저항성과 관련이 있는 H274Y 및 R292K 아미노산 치환 여부를 확인한 결과, 국내 분리주 모두는 이들 아미노산에서의 치환은 나타나지 않았다(Table 2).
PB2 단백질의 E627K 치환은 바이러스 감염이 포유류에 적응하는 것과 관련있는 것으로 알려져 있으나(Subbarao et al., 1993) 국내 분리주 모두는 E627K 치환이 나타나지 않았다. 또 PB2 중합효소(polymerase) 활성과 실험동물 쥐에서의 병원성 상승과 관련된 D701N과 G309D, T339K 치환 여부(Li et al., 2009; Zhang et al., 2014)를 분석한 결과 국내 분리주 모두는 D701N 치환은 확인되지 않았으나 G309D, T339K의 치환은 확인되었다(Table 3).
PB1 단백질의 H436Y 치환은 중합효소 활성과 청둥오리에서의 병원성과 관련된다(Hulse-Post et al., 2007). 국내 분리주 모두는 PB1 단백질의 436번 아미노산이 histidine(H)에서 tyrosine(Y)으로 치환된 것으로 확인되었다. PB1-F2 단백질의 일부 아미노산 결손은 포유류에서의 병원성 증가와 관련되는 것(Zamarin et al., 2006)으로 알려져 있으나 국내 분리주 모두는 PB1-F2 단백질의 아미노산 결손은 나타나지 않았다(Table 3).
PA 단백질의 A515T의 치환은 조류에서의 병원성 증가와 관련된다(Hulse-Post et al., 2007)고 하였는데 국내 분리주 모두는 PA 단백질 515번째 아미노산이 alanine(A)에서 threonine(T)으로 치환된 것으로 나타났다(Table 3).
M1 단백질의 N30D 및 T215A 치환은 쥐에서의 병원성 증가와 관련이 있는 것으로 알려져 있는데(Fan et al., 2009) 국내 분리주들은 모두 30번째 아미노산이 asparatic acid(D)로, 215번째 아미노산은 alanine(A)으로 치환되어 있었다(Table 3).
M2 단백질의 L26P, V27A, S31N의 치환은 인플루엔자 치료약제인 amantadine과 rimantadine에 대한 저항성과 관련이 있다(Belshe et al., 1988; Cheung et al., 2006). 국내 분리주 모두는 이들 부위에서의 변이는 확인되지 않았다(Table 3).
고 찰
H11 아형의 AIV들은 일반적으로 가금류에서는 저병원성을 보이는 것으로 알려져 있다. 그러나 AIV들은 점변이(point mutation) 혹은 유전자 재편성(genetic reassortment) 등으로 인한 변이가 많은 바이러스이기 때문에 지속적인 변이가 있을 경우 가금류에서의 병원성 변화도 나타날 수도 있다. 또한 H11 아형의 AIV는 아직까지 사람에게 감염된 직접적인 증거는 확인되지 않았으나 일부 사람 들에서 H11 아형에 대한 항체가 검출되는 것으로 보아 사람 감염 가능성을 완전히 배제할 수 없다(Gill et al., 2006; Kayali et al., 2011). 이러한 이유 등으로 야생조류에서 분리되고 있는 H11 아형의 AIV에 대한 지속적인 모니터링이 필요하다. 본 연구에서는 국내에서 2012년 이후 야생 조류에서 분리된 H11 아형의 바이러스를 대상으로 AIV 전체 유전자 염기서열을 분석하여 각각의 유전자 특성을 분석하였다.
계통유전학적 분석결과 모든 바이러스 8개 분절 유전자들은 Eurasian lineage에 속하는 것으로 나타났다. 일반적으로 AIV 전파는 철새의 이동과 관련이 있다. 국내로 이동하는 철새들은 동아시아-대양주 철새 이동경로(East-Asian Australasian flyway)를 따라 주로 국내로 이동하며 대서양 아메리카 철새 이동경로(Atlantic Americas flyway), 태평양 아메리카 철새 이동경로(Pacific Americas flyway), 미시시피 아메리카 철새 이동경로(Mississippi Americas flyway) 등으로 이동하는 북미 이동 철새와는 별도의 이동 경로를 가지는 것으로 알려져 있다(Deliberto et al 2009; https://en.wikipedia.org/wiki/East Asian–Australasian Flyway). AIV 전파는 주로 동일한 철새 이동경로를 따라 일어나지만(Fourment et al., 2017) 이러한 철새들의 이동경로가 몽골(Mongolia), 시베리아(Siberian) 혹은 알라스카 반도(Alaskan peninsula)에서 서로 겹치는 경우가 있기 때문에 AIV 전파는 동일 철새 이동 경로뿐만 아니라 다른 철새 이동 경로를 통하여 대륙간의 전파가 일어나고 있다(Dusek et al., 2014; Mine et al., 2019). 국내로 이동하는 철새들은 동아시아-대양주 철새 이동경로를 따라 주로 이동하기 때문에 국내에서 분리되는 AIV는 대부분이 유라시안 계열의 AIV에 속하는 바이러스이지만 일부는 북미-유라시안계열 바이러스들도 확인되고 있다(Lee et al., 2011). 본 연구에서 조사된 H11 아형 분리주 6주에 대하여 각 바이러스별 전체 유전자 8개 분절을 분석하여 계통유전학적 분석을 실시한 결과 48개 유전자 분절 모두가 유라시안 계열의 바이러스로 분류되었고 북미계열의 바이러스 유전자 분절은 확인되지 않아 대륙간 바이러스 전파의 증후는 관찰되지 않았다.
그러나 국내 분리 H11 아형 바이러스의 모든 분절 유전자는 유라시안 계열의 바이러스에 속하였으나 유라시안 계열내에서는 다양한 sublineage로 분류되었다. 예를 들어 HA 유전자의 경우 2018년에 분리된 H11N9 바이러스(A/bean goose/Korea/KNU18-88/2018(H11N9))는 2016년과 2017년 국내에서 분리된 동일한 아형 바이러스인 H11N9 바이러스와는 다른 sublineage로 분류되었고 오히려 2014년 중국 후베이성 야생조류에서 분리된 동일한 아형 바이러스인 H11N9(A/wild bird/Hubei/89/2014(H11N9)) 바이러스와 2019년 방글라데쉬 오리에서 분리된 N 아형이 다른 바이러스인 H11N3(A/duck/Bangladesh/38827/2019(H11N3)) 바이러스와 같은 sublineage로 구분되었다. 또한 N9 아형으로 분류된 4주의 NA 유전자의 경우에도 2018년에 분리된 H11N9 바이러스(A/bean goose/Korea/KNU18-88/2018(H11N9))는 다른 바이러스와 별개의 sublineage로 구분되었으며 2015년 방글라데쉬 오리에서 분리된 H7N9 바이러스와 가장 가까운 근연관계를 보여주었다. 이러한 결과로 미루어 볼 때 국내에서 분리되는 H11 아형 바이러스들도 다른 AIV와 유사하게 바이러스간의 유전자 재편성으로 같은 유라시안 계열내에서도 서로 다른 sublineage 계열의 바이러스로 계속 변이가 일어나고 있음을 추정할 수 있었다.
중합효소 단백질을 암호화하는 PB2, PB1, PA 유전자의 경우에도 모두 유라시안 계열의 유전자로 분류되었으나 유라시안 계열내에서 다양한 sublineage로 분류되는 것으로 나타났다. PB2 유전자의 계통학적 분석결과 국내 분리주들은 2016년 이후 분리주 4주는 그 이전 분리주 2주와는 유라시안 계열내에서도 서로 다른 별개의 sublineage로 분류되었다. PA 유전자의 경우에는 유라시안 계열내에서도 2014년 분리주인 A/wild bird/Korea/KNU14-11/2014(H11N3)만 별도의 sublineage로 분류되었고 나머지 5개 분리주는 다른 sublineage로 구분되었으나 이들도 동일 sublineage 내에서도 또 서로 구분되는 양상을 보였다. 따라서 중합효소 단백질 암호화 유전자에서도 PB2 유전자의 경우에는 분리 년도별 sublineage 차이가 있었으나 다른 중합효소 단백질 유전자인 PB1이나 PA 유전자에서는 이러한 분리 년도별 차이가 나타나지 않았고 또 PA 유전자의 경우 동일 sublineage 내에서도 서로 구분되는 양상을 보이는 것으로 보아 AIV 바이러스간 유전자 재편성은 각각의 분절 유전자 개별로 일어나는 것으로 추정되었다.
NS 유전자의 경우 국내 분리주들은 모두 allele A에 속하였다. NS 유전자는 allele A와 allele B로 나뉘는데 allele B에 속하는 바이러스는 대부분 조류에 제한되어 분리되는데 반하여 allele A에 속하는 AIV는 조류뿐만 아니라 사람, 말, 돼지 등 포유류에서 분리되는 것으로 알려져 있어(Kawaoka et al., 1998) 국내 분리주는 조류 이외의 다른 동물 감염 가능성도 배제할 수 없을 것으로 사료된다.
A/wild bird/Korea/KNU16-34/2016(H11N9)와 A/mallard/Korea/KNU17-7/2017(H11N9) 및 A/mallard/Korea/KNU17-9/ 2017(H11N9)는 각각 2016년과 2017년에 같은 지역(강원도 원주시 섬강)에 서식하는 야생조류로부터 분리된 바이러스이다. 그러나 이들 바이러스 유전자들은 몇 개의 동일한 유전자를 공유하는 것도 있었지만 PB2, NP, M 유전자 등에서는 뚜렷한 차이를 보이는 것으로 나타나 같은 지역에서 분리된 바이러스라 하더라도 유전적 다양성이 있음을 시사하였다.
주요 바이러스 단백질의 분자학적 특성을 분석한 결과 HA 단백질의 cleavage site의 아미노산 서열은 모든 바이러스가 PAIASR/GLF 배열을 가지고 있는 것으로 나타났다. HA cleavage site에서 HA1 단백질의 C-말단 부위의 아미노산이 arginine(R)이나 lysine(K) 등 염기성 아미노산들이 반복적으로 나타나면 일반적으로 고병원성 조류인플루엔자 바이러스로 분류된다(Senne et al., 1996). 본 연구에서 분석한 H11 아형의 7개 바이러스의 HA cleavage site의 아미노산 서열은 모두 PAIASR/GLF 로 저병원성 바이러스의 특성을 보였다.
AIV는 HA 단백질의 RBS 부위의 아미노산 중 숙주세포 수용체 결합과 관련이 많은 부위의 아미노산에서 치환이 일어날 경우 조류의 호흡기도에 주로 존재하는 α-2,3 sialic acid receptor보다 사람 호흡기도 세포에 주로 있는 α-2,6 sialic acid receptor에 결합하는 특성을 가지게 되어 감염숙주가 조류에서 사람으로 바뀔 수 있다(Matrosovich et al., 1997). HA 단백질의 아미노산 중 숙주 특이성과 관련이 많은 A138S, E190D, G225D, Q226L, G228S의 치환 여부를 확인한 결과, 국내 분리주 모두는 이들 아미노산 치환이 관찰되지 않아 사람보다 조류 감염 특성이 더 높을 것으로 추정되었다.
NA 단백질의 줄기부위에서 일부 아미노산 결손이 생길 경우 야생 조류에서 가금류로의 전파도 가능하며 일부의 경우 병원성 상승과도 관련이 있는 것으로 알려져 있다(Matrosovich et al., 1999). 2013년 중국에서 사람에게 감염되었던 고병원성 H7N9는 5개의 아미노산 결손이 관찰되었다(Gao et al. 2013). 본 연구에서는 NA 단백질의 줄기부위에서 아미노산 결손 유무를 분석한 결과 국내 분리주 모두는 이 부위에서의 아미노산 결손은 확인되지 않았다.
인플루엔자 바이러스의 치료 약제는 바이러스 단백질중 NA를 억제하는 기전과 M2 단백질의 이온 채널(ion channel)을 방해하는 기전의 약제들이 사용되고 있는데 이들 치료 약제들에 대한 저항성 여부를 알아보기 위하여 NA 단백질과 M2 단백질에서의 관련 아미노산의 치환을 조사하였다. NA 단백질 중 H274Y 및 R292K 아미노산 치환은 NA 억제 항바이러스 약제인 oseltamivir과 zanamivir에 대한 저항성과 관련이 있다(Collins et al., 2008; Yen et al., 2013). 국내에서 분리된 H11 아형 바이러스 모두는 이들 NA 단백질에서의 아미노산 치환은 나타나지 않아 이들 항바이러스 약제에 대하여는 저항성이 나타나지 않을 것으로 추정되었다. 또한 M2 단백질의 이온 채널 억제 약제인 amantadine과 rimantadine에 대한 저항성은 M2 단백질의 L26P, V27A, S31N의 치환과 관련 있는 것으로 알려져 있는데(Belshe et al., 1988; Cheung et al., 2006) 국내 분리주 모두는 이들 부위에서의 변이가 확인되지 않아 이들 약제에 대한 저항성도 발휘되지 않은 것으로 추정되었다.
바이러스 단백질 중 사람을 포함하는 포유류에 대한 병원성 증가와 관련이 있는 것은 HA 단백질의 RBS를 포함하여 매우 다양한 단백질의 아미노산이 관련이 있는 것으로 알려져 있다. 국내에서 분리된 H11 아형의 바이러스를 대상으로 포유류 감염가능성을 알아보기 위하여 관련 부위의 아미노산을 분석한 결과 국내분리주 모두는 HA 단백질의 RBS 부위 아미노산 치환은 확인되지 않았고 NA 단백질의 줄기부위 아미노산 결손도 관찰되지 않았다. 또한 포유류 감염 적응과 관련된 PB2 단백질의 E627K 치환도 확인되지 않았다. 또한 포유류에서 병원성 증가와 관련이 있다고 알려진 PB1-F2 단백질의 일부 아미노산 결손도 확인되지 않았다. 이러한 결과들을 고려할 경우 국내 분리 H11 아형 바이러스 모두는 포유류에서의 병원성 증가 가능성은 높지 않은 것으로 판단되었다. 그러나 포유류 감염과 관련이 있는 일부 아미노산에서의 변이는 관찰되었다. 즉, M1 단백질의 N30D 및 T215A 치환은 쥐에서의 병원성 증가와 관련이 있는 것으로 알려져 있는데(Fan et al., 2009) 국내 분리주들은 모두 30번째 아미노산이 asparatic acid(D)로, 215번째 아미노산은 alanine(A)으로 치환되어 있었다. 또한 실험동물 쥐에서의 병원성 상승과 관련된 PB2 단백질의 D701N과 G309D, T339K 치환 여부(Li et al., 2009; Zhang et al., 2014)를 분석한 결과 국내 분리주 모두는 G309D, T339K의 치환이 확인되었다. 따라서 국내 분리주들은 현재로는 포유류 감염 가능성은 높지 않은 것으로 추정되지만 포유류 감염과 관련된 유전자의 일부에서 변이는 나타나고 있는 것으로 추정되었다. 본 연구결과 국내분리주 H11 아형의 AIV 모두는 가금에서 저병원성 특성을 보이고 있는 것으로 나타났고 또한 포유류 감염 가능성도 낮은 것으로 분석되었다. 하지만 AIV는 지속적인 변이가 계속해서 나타나는 바이러스이기 때문에 H11 아형의 바이러스의 경우에도 가금류 및 사람으로의 감염 가능성을 확인하기 위하여 지속적인 모니터링이 필요할 것으로 사료되었다.








