서 론
배아 발생 과정의 여러 단계에서 마주보며 다가오는 두 상피조직 판이 접촉하고 융합되어 하나의 연속적인 구조를 형성하는 경우가 다수 존재한다(Keller, 2002; Ray and Niswander, 2012). 이러한 조직융합 과정은 척추동물의 배아 발달 중 여러 장기 및 조직의 형성의 기본 원리 중 하나이며, 이 과정에서의 문제는 선천성 기형으로 이어질 수 있다(Perez-Pomares and Foty, 2006; Ray and Niswander, 2012). 또한 일반적 발생과정뿐 아니라, 표피가 손상된 곳에서 스스로 조직을 복구하는 상처치유과정에서도 관찰된다(Jacinto et al., 2001). 상피조직 판의 움직임은 주로 가장자리에 위치한 세포의 이동에 의해 주도되며(Petrie and Yamada, 2012), 이는 세포의 이동하는 방향면의 세포 골격 재편성 및 층상위족 활동에 의한 물리적 장력조절에 의해 제어된다(Onochie et al., 2019). 초기 접합부는 신경관(neural tube) 형성 과정 연구에서 많이 밝혀진 것처럼 상피 시트 조직 판의 앞쪽 가장자리를 따라 형성되어 두 상피를 결합한다(Pyrgaki et al., 2010; Rolo et al., 2016; Vijayraghavan and Davidson, 2017). 새로운 세포 간 접합 생성을 위한 접촉 및 신호 전달을 감지하는 것은 다양한 세포학적 과정(예: actin polymerization)을 포함한 복잡한 현상이며(Vasioukhin et al., 2000), 다른 시스템에서 이러한 현상이 어떻게 발생하는지, 이에 대한 생물학적 원리를 파악하고, 제어하는 방법을 발굴하는 것은 조직 공학 기술의 목표와 밀접하게 연계된다. 그럼에도 불구하고 척추동물에서의 조직융합의 세포 수준의 기작은 아직까지 잘 밝혀져 있지 않고 연구모델 또한 부족하다.
닭 배아는 포유류와 유사한 발생 과정을 가지며, 연구모델로서 실험적, 경제적 접근성이 높아 인간을 포함한 고등 척추동물의 발생 메커니즘을 연구하는 데 유용하다. 닭 배아는 발달 단계가 명확히 구분되며(Hamburger and Hamilton, 1951), 여러 발생단계에 세포 및 조직의 변화를 비교적 쉽게 추적할 수 있다. 원반형태의 닭 배아는 부화 과정동안 점점 확장하며 4~5일이 지나면 난황 전체를 둘러 감싸게 된다. 이 확장은 배아의 가장자리에 위치한 특수한 세포에 의해 주도되며, 이 ‘가장자리’ 세포는 배아 내 존재하는 모든 세포 중에 난황막의 안쪽(난황을 향한) 표면에 부착되는 유일한 세포군이다(New, 1959; Lee et al., 2022). 일반적인 상피 조직의 융합 또는 상처치유과정에서의 인접한 상피 조직의 앞쪽 가장자리에선 세포 위족이 형성되며 조직융합을 주도한다고 알려져 있다(Martin and Parkhurst, 2004). 이와 유사하게, 넓고 평평한 층상위족 및 뾰족한 사상위족이 닭 배아의 가장자리 세포에서 뻗어 나오며, 이를 통해 닭 배아 확장과정 동안 가장자리 세포는 다른 상피조직융합 과정과 유사한 방식으로 이동하는 것으로 생각된다(Bellairs, 1963; Bellairs et al., 1969; Lee et al., 2022).
그동안 시험관 및 생체 내 상처 치유 연구에서, 초파리와 같이 유전적으로 다루기 쉬운 종의 형태발생적 움직임에 대한 분석을 통해 상피 융합에 관한 신호와 세포운동성을 유발하는 세포골격을 식별한 바 있다(Affolter et al., 2009; Polyakov et al., 2014). 하지만 척추동물의 초기배아의 상피조직에 대한 연구는 초기 발생단계 배아 회수의 어려움, 체외배양 기술의 한계 등으로 인해 많이 알려져 있지 않다. 본 연구에서는 선행 연구에서 밝혀진 닭 배아의 가장자리 세포의 특성과 상피세포 융합 과정의 유사점(Lee et al., 2022)을 이용해 닭 배아에서의 상피 융합 과정을 관찰하며 특히 닭 배아의 epiboly의 마지막 단계를 간접적으로 관찰한다. 또한 가장자리세포에서 특이적으로 발현하는 유전자 마커를 활용하여 상피조직융합 과정동안 유전자별 발현 변화를 분석한다. 마지막으로 조직융합 후 세포의 추가이동 및 섞임 여부 검증을 위해 세포 염색을 통해 관찰한다.
재료 및 방법
수정된 하이라인 브라운(Hy-line Brown) 종 계란(대한민국 나주, 벧엘농장)을 38°C에서 24시간 동안 배양하여 H&H stage 6—7인 배아를 획득하였다(Hamburger and Hamilton, 1951). 획득한 배아는 난의 내부와 유사한 환경에서 미세수술 및 실험적 조작을 하기 위해 New가 개발한 체외배양법을 통해 다음과 같이 배양시켰다(New, 1955).
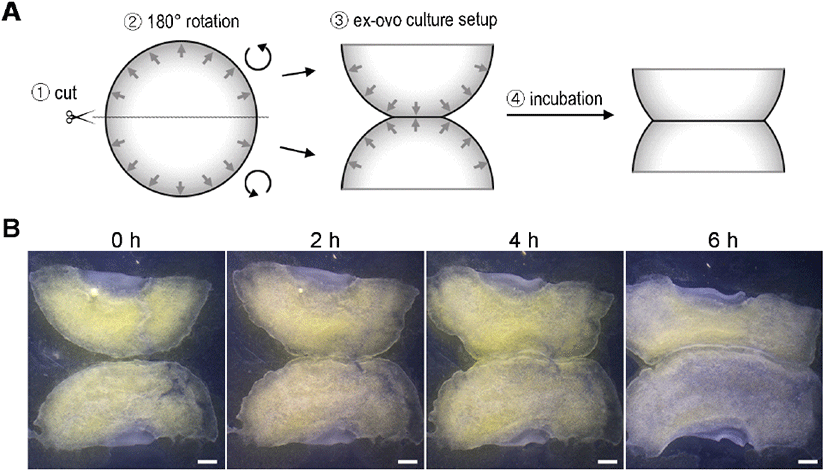
난각의 반(첨단부 또는 둔단부)을 제거한 뒤, 약숟가락을 사용하여 알부민을 최대한 제거한다. 이때, 체외배양 시 필요한 묽은 알부민은 모아둔다. 알부민을 제거한 달걀을 Pannett-Compton 수용액(Pannett and Compton, 1924)에 담근 채, 난황을 둘러싼 난황막을 벗겨내고 배아를 난황막에서 분리한다. 난황막은 링에 씌우고 배아는 반으로 잘라 배아의 가장자리 부분이 서로 마주 보도록 하여(배아의 반쪽만 180° 회전) 난황막 위에 올려준다(Fig. 1A). 이때, 난황막과 배아가 모두 난황 쪽을 향했던 부분이 위로 가도록 하며 방향을 일치시킨다. 물기를 최대한 제거하여 막에 배아를 밀착시킨 후, 2.5 mL 묽은 알부민이 담긴 35 mm 배양접시에 링 째로 막과 배아를 옮겨준다. 이것을 38°C 배양기에서 5~6시간 동안 키워준다.
목적한 시간만큼 배양된 배아는 고정을 위해 4% paraformaldehyde를 적당량 처리한 후, 날카로운 포셉으로 난황막으로부터 분리한다. 막에서 분리된 배아를 4% paraformaldehyde에 보관한 채 4°C에서 24시간 또는 상온에서 1시간 고정시킨 후, 최소 24시간 동안 100% 메탄올에서 탈수시킨다.
고정시킨 배아는 기존에 알려진 mRNA in situ hybridization을 거쳐 유전자 발현을 확인한다(Stern, 1998). 먼저, 차례대로 75%, 50%, 25% 메탄올에서의 수화 과정을 거친 후, 효과적인 프로브 및 항체 침투를 위해 proteinase K 처리를 통해 처리한다. 0.1% glutaraldehyde가 포함된 4% paraformaldehyde에서 30분 동안 후고정시킨다. 이후, 발현을 확인할 유전자의 프로브를 사용하여 70°C에서 hybridization 과정을 하루 동안 수행한다. 본 실험에서 사용한 유전자는 dishevelled binding antagonist of beta catenin 2(DACT2), ribonuclease/angiogenin inhibitor 1(RNH1), 그리고 snail family transcriptional repressor 2(SNAI2)이다(Lee et al., 2022). 그 후, 여러 번의 세척 과정을 거친 후, blocking buffer(1 mg/mL의 bovine serum albumin과 5%의 heat-inactivated goat serum이 포함)에서 3시간 배양시킨다. Anti-Digoxigenin AP antibody(11093274910, Sigma-Aldrich)를 blocking buffer에 희석(1:5,000)시킨 용액으로 교체한 뒤, 4°C에서 하루 동안 배양해 항체를 부착시킨다. 그 후, antibody 세척 과정을 거친 후 NBT-BCIP를 포함된 발색 용액을 배아에 처리해 발현을 관찰한다. 발색이 완료된 배아는 4% paraformaldehyde에서 장기간 보관할 수 있다.
2 mM DiI(C7000, ThermoFisher) 1 μL을 Pannett-Compton 수용액 500 μL와 혼합해 염색 용액을 만든다. 반으로 자른 배아의 한 쪽은 염색 용액에 담그고, 나머지 한 쪽은 Pannett-Compton 수용액에 담근 후, 38°C 배양기에서 30분간 배양해 배아를 염색시킨다. 염색 후 체외배양 전에 Pannett-Compton 수용액에서 수 차례 세척한다.
DiI 염색을 거친 샘플을 제외한 모든 배아는 실체 현미경(LEICA S9D) 및 광학삼안현미경(MIC S16C)을 사용하여 관찰 및 촬영하였다. DiI 염색된 배아는 형광현미경(LEICA DM IL LED, CoolLED pE-300)으로 관찰 및 촬영하였다.
유전자 발현 두께 정량은 ImageJ(Schneider et al., 2012)를 사용하였다. 측정값에 대한 평균 도표화는 PRISM 6 프로그램을 사용하였다. 동 프로그램을 사용하여 One way ANOVA 분석을 통해 평균비교를 한 뒤 Tukey’s 다중비교를 사용해 사후검정을 하였다.
결과 및 고찰
닭 배아의 확장과정(epiboly) 동안 가장자리 조직(상피조직)은 난황을 따라 감싸며 4일 정도 후에 전체 난황을 덮게 된다. 하지만 얇은 세포층으로만 이루어진 그 단계의 특성상 조직 회수가 어렵고 시간별 관찰이 쉽지 않아 연구가 되어 있지 않다. 본 연구에선 닭 배아의 epiboly의 마지막 단계, 즉 조직이 닫히는 과정을 간접적으로 관찰하기 위해 원반형태의 배아를 반으로 잘라 서로 마주보게 한 뒤 체외배양을 수행하며 배아의 모습을 촬영했다(Fig. 1A). 배양 시간이 지남에 따라 배아가 확장하면서 서로 마주보는 가장자리 조직끼리 점진적으로 붙는 모습이 관찰되었다(Fig. 1B). 배양 후 2시간이 경과했을 때는 가장자리 부분의 1/3, 4시간이 지났을 때는 절반 정도가 붙었으며, 6시간이 지났을 때는 가장자리의 2/3정도의 부분이 접합된 모습을 보였다(Fig. 1B). 서로 가까이 위치한 조직부터 먼 조직까지 점진적으로 접합되는 것을 볼 때, 가장자리의 부위별 이동속도는 차이가 없는 것을 생각된다. 또한 반으로 자른 상처부위의 경우, 난황막에 부착 및 조직확장이 되지 않는 것으로 보아, 부착 및 확장하는 특성은 원래 배아의 가장자리세포에 국한되며 대부분의 지역에서 새로 획득되지 않는 것으로 확인된다(Fig. 1B) (New, 1959; Lee et al., 2022).
다음으로 가장자리 조직의 융합 여부 및 시간 및 난황막 부착 여부에 따른 가장자리 특이적 마커의 발현양상을 확인하기 위해 whole-mount mRNA in situ hybridization을 진행하였다. 마커로는 선행 연구에서 가장자리 세포에서 발현한다고 보고된 DACT2, RNH1, 그리고 SNAI2를 사용하였다(Lee et al., 2022). 세 유전자 모두 상처치유과정에서 특이적으로 발현할 뿐 아니라 치유과정을 매개하는 중요한 역할을 하는 것으로 알려져 있다(Hudson et al., 2009; Kim et al., 2020; Neu et al., 2024). 마커의 지역별 발현비교를 위해, 배아에서 총 4가지 지역(I-IV)을 다음과 같이 구분하였다(Fig. 2A): (I) 접합된 후 시간이 경과된 가장자리(closed edge, old), (II) 접합된 지 얼마 안 된 가장자리(closed edge, young), (III) 접합되지 않은 가장자리(free edge), (IV) 배아를 반으로 잘랐을 때의 상처부위(cut edge, wound). 또한 각 지역에서의 발현차이를 구체적으로 분석하기 위해 발현 부위의 두께를 측정하여 정량 및 비교하였다. 평균 비교를 위해 사용된 유전자별, 배아의 수는 최소 5, 총 측정지역의 수(Figs. 2H, 2I, and 2J의 n수)는 최소 15 이상이다.
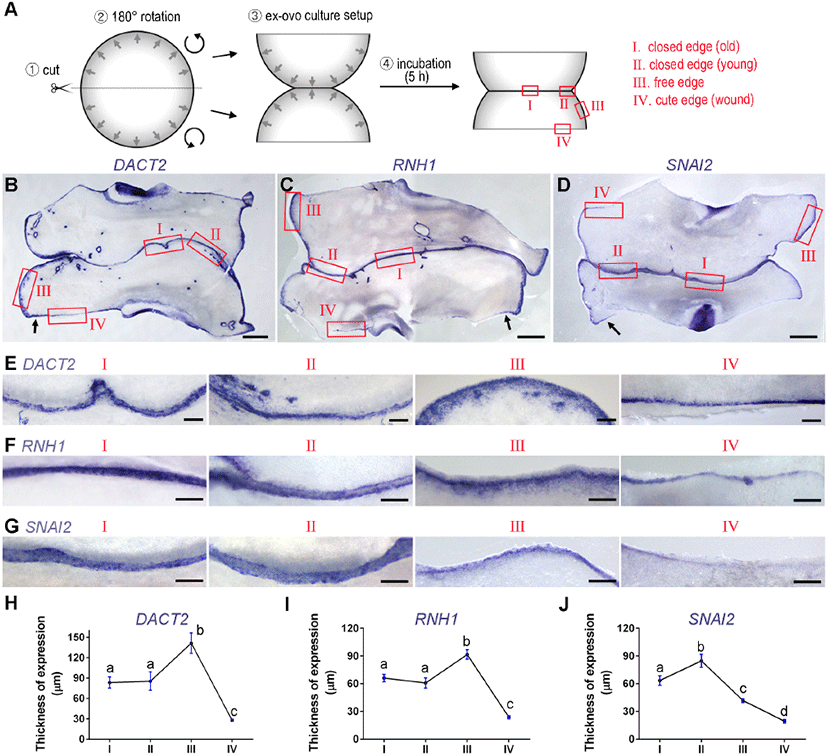
세 유전자 모두, 배아 내 발현(expression in the embryonic tissue)을 제외하고 바깥의 배아외조직(extraembryonic tissue)의 가장자리에서 특이적인 발현을 보였으며 다음과 같은 결과를 보였다. 먼저, 세 유전자 모두 free edge인 III 지역에서 정상 배아의 가장자리보다 두꺼운 발현(최소 30 μm~최대 100 μm 이상)을 보였다 (Figs. 2 B, 2C, 2D, 2E, 2F, and 2G의 III 지역들). 이는 기존에 보고된 바와 같이, 준비과정에서 배아가 막에서 분리된 후 재부착(reattachment)하는 과정을 통해 생긴 현상으로 보인다(Lee et al., 2022). 발현 두께의 증가는 가장 바깥쪽(가장자리)보다 안쪽(비가장자리)에 위치한 세포 들에서의 신규발현을 의미하며, 이는 reattachment 과정 중 비가장자리 세포들을 포함한 배아의 바깥쪽에 있는 세포들이 가장자리세포화(가장자리세포의 특성을 획득)되는 것을 시사한다(New, 1959). 즉, reattachment를 통한 물리적 환경 변화가 배아 끝 쪽의 세포를 언제든 붙을 수 있는 상태로 준비시키는 것으로 생각된다.
두 번째로 세 유전자에서 조금 다른 형태로 접합 후에 발현 두께가 줄어드는 것이 관찰되었다. DACT2와 RNH1의 경우, free edge(III)에 비해 closed edge(I 및 II)에서 두께가 줄어들었고(Figs. 2B, 2C, 2E, 2F, 2H, and 2I), SNAI2의 경우 young closed edge(II)에 비해 old closed edge(I)의 발현 두께가 줄어 들었다(Figs. 2D, 2G, and 2J). 두 경우의 형태는 다르지만, 발현 두께가 줄어드는 것은 가장자리 조직의 접합에 의해 free edge가 없어지면서, 더 이상 비가장자리 세포들의 가장자리세포화가 필요 없어진 것으로 사료된다. 조직 접합 후에 가장자리 조직의 막 부착 상태의 변화에 따른 원인인지는 확인되지 않았다.
마지막으로 배아 가장자리뿐 아니라 cute edge(IV), 즉 상처부위에도 세 유전자의 발현이 관찰 되었다(Figs. 2B, 2C, 2D, 2E, 2F, and 2G의 IV지역들). 다른 나머지 지역(I—III)에 비해, 1—3 세포층 두께의 얇은 발현 양상이 관찰되었다(Figs. 2H, 2I, and 2J). 이는 세 유전자가 다양한 상황의 가장자리에 위치한 세포에서 공통적으로 발현함을 보여주며, 일반적인 gap closure와 wound closure에서의 가장자리세포가 유사한 원리로 closure를 주도할 것이라는 추측을 가능케 한다. 추가적으로 배아의 가장 바깥쪽으로부터 500~1,000 μm 거리 안에 있는 cut edge(IV)의 경우, 얇은 발현을 보이는 다른 IV 지역과 달리 free edge(III)와 같은 두께의 발현을 보였다(arrows in Figs. 2B, 2C, and 2D). 이 결과는 두 가지 원인을 추측할 수 있는데, 첫 번째는 주변 가장자리세포의 이동으로 인한 발현증가, 두 번째는 비가장자리세포의 가장자리세포화이다. 기존 연구에서 배아 바깥 쪽에 가까운 비가장자리세포의 경우 wound 상황에서 가장자리세포처럼 막에 부착 및 조직확장을 보이는 것으로 보아 두 번째 설명이 더 가능성이 높은 것으로 생각된다(New, 1959).
다음으로 가장자리 조직의 접합 과정에서 마주보는 조직의 세포의 섞임 및 이동 여부를 관찰하기 위한 실험을 진행하였다. 배아를 반으로 잘라 가장자리 부분끼리 맞붙여 배양하는 것은 동일하지만, 반으로 자른 배아에서 한 쪽만 세포막 및 일부 세포질을 염색하는 지질친화성 염색약인 DiI로 처리한 뒤 조직접합 및 배양을 진행하였다(Fig. 3A, n>10). 배양 전과 배양 후 16시간의 배아를 각각 형광 현미경으로 관찰한 뒤 middle과 hinge 부분의 세포 이동양상을 분석하였다(Figs. 2A and 2B).
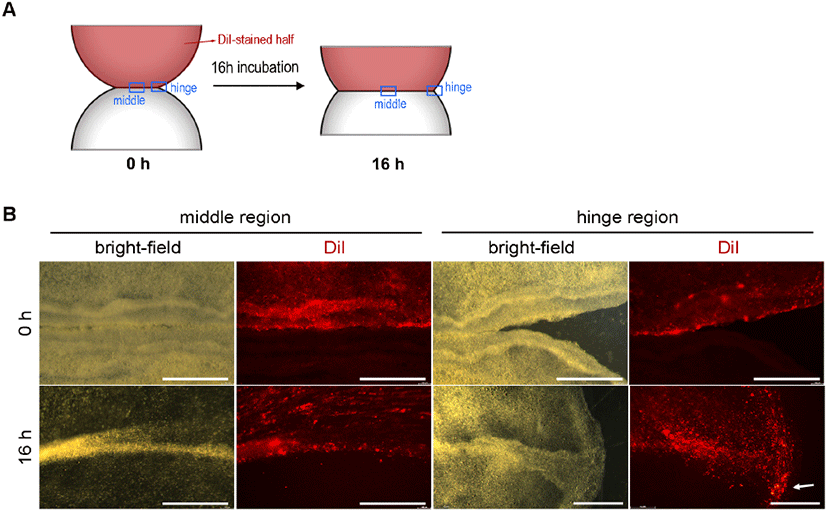
16시간 배양 후 형광 현미경으로 관찰한 결과, middle 지역에서는 마주보는 조직끼리 붙은 경계를 기준으로 (소수의 세포를 제외하고) 이동한 세포가 거의 관찰되지 않았다(Fig. 3B). 하지만, hinge 지역, 즉 가장자리 조직끼리 접합이 시작되는 부분에서는, DiI 염색된 배아의 세포들의 다수가 반대 반쪽 배아 쪽으로 이동한 것이 관찰되었다(Fig. 3B). 이러한 배아의 경우 hinge 부분이 움푹 들어간 곳 없이 매끄럽게 메꿔진 것을 보아, 접합된 경계를 따라 이동한 결과라고 예상할 수 있다. 하지만 왜 hinge에 위치한 세포들은 다른 행동을 보이는지에 대한 설명은 추가 연구가 필요하다.








