서 론
동물의 면역은 외부로부터 침입하는 다양한 물질에 대응하는 생물학적 방어기작을 말한다. 영양소의 흡수와 소화를 담당하는 소화 장관에 존재하는 장관 면역은 대표적 점막 기관으로 특히 동물의 생리 대사와 항병력 모두에 중요한 역할을 담당한다. 예컨대, 동물의 장관 면역은 경제동물의 경제형질에 영향을 미친다는 연구 결과가 보고된 바 있다(Lee et al., 2016; Broom and Kogut, 2018). 산란계의 경우 달걀 품질과 같은 대표적 경제형질과 혈중 면역글로불린(IgA, IgG, IgM)의 농도, 염증성 사이토카인 농도가 연관되어 있다는 연구 결과가 보고된 바 있다(Wang et al., 2019; Gan et al., 2020).
이러한 장관 면역의 항상성 유지에는 다양한 외부적 요인이 관여한다. 특히 동물이 섭취하는 사료 내 영양 조성이나 기능성 물질의 섭취는 장내 미생물과 같은 장내 환경을 구성하는 중요 요인들을 변화시켜 동물의 면역을 조절할 수 있음이 보고되었다(Round and Mazmanian, 2009; Veldhoen and Brucklacher-Waldert, 2012; Amoroso et al., 2020).
동물이 태어난 후 장내에 정착하는 장내 미생물은 서로 다른 미생물 간의 상호작용을 통하여 동물의 대사 및 면역 항상성 조절에 큰 영향을 미친다(Qamar et al., 2021). 특히 기후환경이나 급격한 사료 변화와 같은 사양 스트레스 요인으로 인해 장내 미생물 균총이 변화하면 동물의 면역 항상성이 변화한다(Rio et al., 2024). 이는 장내 미생물 균총 중 유익균이 감소하고 유해균이 증가하는 장내 미생물의 불균형을 초래하며 이는 질병을 야기하거나 성장을 저해할 수 있다(Shi et al., 2017). 따라서 다양한 외부적 요인에 의해 변화하는 장내 미생물 균총은 경제동물의 경제형질과 항병력을 결정하는 매우 중요한 지표라 할 수 있다.
공장식 축산 형태로 운영되는 양계산업에서 산란계의 건강이나 항병력은 매우 중요한 문제이다. 산란계의 건강을 개선하기 위하여 기존에는 항생제를 사료에 첨가하여 산란계의 건강을 향상시키는 방식을 이용하였지만, 장기적인 항생제 사용은 오히려 장내 미생물 균총의 불균형을 발생시켜 장관 면역 유지 및 조절에 어려움을 줄 수 있다(Jernberg et al., 2007). 또한 항생제의 장기 사용은 항생제 내성 박테리아의 출현으로 이어지며, 이는 경제동물과 이를 이용하는 인간의 건강에 심각한 위협으로 작용할 수 있다(Abe et al., 1995; Jans et al., 2018; Kim et al., 2019). 따라서 식물 추출물이나 생균제, 무기질 등을 이용하여 산란계의 사양 성적, 장 건강 개선에 의한 면역력 증진을 통해 기존 항생제를 대체할 수 있는 기능성 첨가제 개발 연구가 진행되고 있다(Rowghani et al., 2007; Yun et al., 2008; Park et al., 2009; Kang et al., 2013).
최근 사료 첨가제의 일환으로 미세조류가 큰 주목을 받고 있다. 미세조류는 광합성을 통하여 대기 중의 이산화탄소를 흡수하고 산소를 생산하며, 다양한 형태의 유기물을 생산할 수 있는 미생물이다(da Silva Vaz et al., 2016). 또한 생물 다양성이 매우 높으며 특정 조건에서 베타카로틴(β-carotene), 아스타잔틴(astaxanthin)과 같은 항산화 물질을 생성하므로 경제동물 사료 첨가제로서의 활용 가능성이 주목받고 있다(Skjånes et al., 2013; Sun et al., 2018; Kim et al., 2023). 실제로 미세조류의 첨가 급여가 장내 미생물의 균총을 조절하고 면역 항상성 유지에 도움이 된다는 연구 결과도 보고된 바 있다(Sagaram et al., 2021). 담수 미세조류의 일종인 Mychonastes pushpae (MP)는 국내 토착종으로 베타카로틴이나 루테인(lutein)과 같은 항산화 물질이 다량 함유되어 있으며, 정상세포 생장 촉진과 암세포 억제 능력이 우수하다고 알려져 있다(Jang et al., 2021; Lee et al., 2023). 그러나, 산란계용 사료 첨가제로써 미세조류의 사용 가능성 특히, 장관 면역과 장내 미생물에 미치는 영향에 대한 연구는 매우 부족하다. 따라서 본 연구에서는 산란계 사료에 첨가한 미세조류(MP)가 계란 생산성과, 장관 면역, 그리고 장내 미생물 균총에 미치는 영향을 평가하여 사료 첨가제로의 활용 가능성을 확인하고자 한다.
재료 및 방법
본 연구의 동물실험은 건국대학교 동물실험윤리위원회 규정에 따라 진행되었다(승인번호: KU21083).
본 연구에 사용된 미세조류 Mychonastes pushpae (MP)는 낙동강 상주보(대한민국 상주)에서 채취되어 국립낙동강생물자원관(대한민국 상주)에 저장되었다. 미세조류(MP)의 배양을 위해 BG-11 배지(K2HPO4 0.59 g/L, NaNO3 4.25 g/L, MgSO4·7H2O 0.075 g/L, CaCl2·2H2O 0.036 g/L, ferric ammonium citrate 0.006 g/L, citric acid 0.006 g/L, Na2CO3 0.02 g/L, ethylenediaminetetraacetic acid 0.001 g/L, trace metal mix A5 solution(H3BO3 2.86 g/L, MnCl2·4H2O 1.81 g/L, NaMoO4·2H2O 0.222 g/L, CuSO4·5H2O 0.079 g/L, CoCl2·6H2O 0.05 g/L) 1 mL를 121°C, 1.5 기압에서 15분간 멸균하여 사용하였다. 통기가 가능한 100 L 평판형광생물반응기에 5% 이산화탄소 기체가 함유된 공기를 0.1 vvm씩 주입하였다. 배양 온도는 22±1°C로 설정하였고, 광도는 500 kW 백색 LED 광패널 2기를 이용하여 연속적으로 공급하여 MP를 대량 배양하였다. MP의 균체를 얻기 위하여 연속 원심분리기를 통해 배지를 13,700 g에서 원심분리하였고, −80°C에서 하루동안 동결건조하여 실험 사용시까지 보관하였다.
57주령 하이라인 브라운(Hy-line Brown)종 산란계 96수를 산란 케이지(45 cm × 45 cm × 45 cm)에 무작위 배치한 후, 1주일간 적응기간을 가졌다. 이후 각 처리구 별로 미세조류(MP) 첨가 처리구 사료와 및 미첨가 대조구 사료를 급여하였다. 실험에 사용한 사료의 원료와 구성성분은 Table 1과 같으며, 미세조류 처리구는 기본 사료에 미세조류 0.5%를 첨가하여 4주간 급여하였다. 사료와 물은 자유 급식을 하였고, 계사 내 온도는 33°C, 습도 40~50%, 24시간 연속 점등 조건에서 사육하였다. 본 연구에서는 실험 초기에 전체 병아리 대상으로 개별 식별 마크를 부여하였으며, 이후 난괴법을 활용하여 각 개체의 체중을 기준으로 두 그룹으로 나누어 각 처리군을 구성하였다. 각 처리구에는 2처리 8반복당, 6수를 배치하였다.
각 반복구당 사료섭취량을 기록하였고, 이는 산란계당 일일 사료섭취량(feed intake, g/d/bird) 계산에 이용되었다. 산란율(egg production, %)과 난중(egg weight, g)은 매일 기록하였고, 이를 통해 산란량(egg mass, g/day)을 구하였다. 사료요구율(feed conversion ratio, FCR)은 각 반복구당 사료섭취량을 산란량으로 나누어 구하였다. 실험 4주차 마지막 3일 연속으로 반복구당 6개의 알을 채란하여 난질 측정에 이용하였다. 난각 색(eggshell color)은 난각반사계(TSS QCR, Technical Services and Supplies, York, UK)를 이용하여 측정하였다. 호유닛, 난각 강도, 난각 두께(난각막 제외)와 난황 색 점수는 digital egg tester(DET-6000, Nabel, Kyoto, Japan)를 이용하여 조사되었다.
산란계 소장 고유층 세포(Lamina propria cells, LP cells)를 분리하는 과정은 이전에 보고된 방법에 따라 시행하였다(Chen et al., 2022). 소장 중 공장 조직을 분리하여 10% fetal bovine serum(FBS; Gibco BRL, Burlington, ON, Canada), 1% penicillin-streptomycin(P/S; HyClone Laboratories, Logan, UT)이 첨가된 RPMI 1640(Gendepot, Barker, TX, USA) 배지(cRPMI)가 담긴 용기로 옮기고, 지방과 장 사이의 막을 제거하였다. 장의 세로축을 따라 가위로 자르고 핀셋으로 소장을 차가운 인산완충생리식염수(phosphate buffered saline, PBS; Gibco, Life Technologies, São Paulo, Brazill)에 세척하여 소장의 내용물과 점액을 제거한 다음 1~1.5 cm의 길이로 잘랐다. 이 조직을 차가운 PBS로 세척한 다음 세포분리용액(30 mM ethylene-diamine-tetra acetic acid(EDTA; Thermo Fisher Scientific, Waltham, MA, USA), 1 mM DL-dithiothreitol (DTT; Sigma-Aldrich, St. Louis, MO, USA), 10 mM 4-[2-hydroxyethyl]-1-piperazineerhanesulfonic acid(HEPES; Thermo Fisher Scientific, Waltham, WA, USA)이 첨가된 PBS에 넣어 200 rpm, 37°C 조건의 진탕배양기에서 10분간 처리하였다. 이후, 조직을 세포분리용액이 첨가된 PBS를 사용하여 1분간 세척하고, 30 Mm EDTA와 10 Mm HEPES가 함유된 PBS로 옮겨 200 rpm, 37°C 조건의 진탕배양기에서 10분간 처리했다. 그 후 조직을 차가운 PBS로 세척하고, 5 mL의 cRPMI 1640(GenDEPOT, Barker, TX, USA)으로 옮겨 2분 동안 중화하였다. 마지막으로 collagenase type VIII (Sigma-Aldrich, Chem, USA)를 0.5 mg/mL 첨가한 cRPMI에 조직을 넣고 200 rpm, 37°C 조건의 진탕배양기에서 1시간 동안 처리하였다. 이후 원심분리기(800g, 10분, 4°C)와 흡입기로 상층액을 제거하였다. Percoll(GE Healthcare/Amersham, Bucking-hampshire, UK)를 사용하여 밀도차에 의한 원심분리(상단에 40% Percoll, 하단에 70% Percoll)를 통해 소장 고유층 내 면역세포를 분리하였다.
소장 고유층 내 면역세포를 분석하기 위해 FACS Canto II(Becton Dickinson, Heidelberg, Germany)를 사용하였고, 이후 FlowJo software v10.7.1(Tree Star Inc., OR, USA)를 활용하여 데이터 분석을 실시하였다. 각 항체를 1:200 비율로 PBS에 희석하여 세포를 염색하였으며, 살아있는 세포를 대상으로 분석하기 위해 LIVE/DEAD™ Fixable aqua dead cell stain kit(Invitrogen, Thermo Fisher Scientific)를 1:1,000 비율로 PBS에 희석하여 항체와 함께 사용하였다. 어두운 조건에서 30분 동안 항체와 세포를 반응시킨 후, 원심분리기(800 g, 5분, 4°C)를 사용하여 상층액을 분리하고 흡입기로 제거하였다. 세포를 고정하기 위해 4% phosphate-buffered formalin (4% PFA; Biosesang Co., Ltd, Republic of Korea)을 200 μL 사용하였고, 이후 어두운 조건에서 측정 전까지 4°C 냉장고에 보관했다.
이 연구에서 사용한 항체는 다음과 같다. 소장 내 대식세포와 B 세포를 분석하기 위해 FITC-conjugated mouse anti chicken MHC II(8350-02, SouthernBiotech Birmingham, AL, USA), PE-conjugated mouse anti-chicken Mono/Macro(8420-09, SouthernBiotech, LA, USA), Alexa Fluor 647-conjugated mouse anti-chicken Bu-1(8395-31, SouthernBiotech, LA, USA) 항체를 사용했다. 또한, 소장 내 T 세포를 분석하기 위해 Pacific Blue-conjugated mouse anti-chicken CD3(8200-26, SouthernBiotech, LA, USA), FITC-conjugated mouse anti-chicken CD4(8210-02, SouthernBiotech, LA, USA), PE-conjugated mouse anti-chicken TCRγδ(8230-09, SouthernBiotech, LA, USA), SPRD-conjugated mouse anti-chicken CD8α(8220-13, SouthernBiotech, LA, USA) 항체를 사용하여 분석하였다.
사료에 미세조류를 첨가한 후 장내 미생물 변화를 알아보기 위해, 실험동물을 CO2 호흡 마취로 안락사한 후 맹장 내용물을 수집하였다. 이렇게 수집된 모든 시료는 DNA 추출 및 장내 미생물 군집 분석을 위해 −80°C 초저온 냉동고에 보관되었다.
DNA는 DNeasy PowerSoil Kit(Qiagen, Hilden, Germany)를 사용하여 제조사의 권장 프로토콜에 따라 추출되었다. 추출된 DNA는 Quant-IT PicoGreen(P7589, Invitrogen)을 이용하여 정량적으로 분석되었다. 장내 미생물 군집 분석을 위한 이후 과정은 일루미나(Illumina Inc.)에서 제공한 16S Metagenomic sequencing lirary 프로토콜을 준수하여 진행되었다. Amplicon PCR 과정에서는 16S rRNA gene의 V3-V4 영역이 타겟으로 선택되었으며, 사용된 프라이머 염기서열의 V3는 5’-TCG TCG GCA GCG TCA GAT GTG TAT AAG AGA CAG CCT ACG GGN GGC WGC AG-3’ (forward primer), V4는 5’-GTC TCG TGG GCT CGG AGA TGT GTA TAA GAG ACA GGA CTA CHV GGG TAT CTA ATC C-3’ (reverse primer)로 마크로젠(Macrogen, Inc., Seoul, Korea)에서 제작되었다. 라이브러리 제작은 마크로젠에 위탁되어 Miseq(Illumina, San Diego, USA)를 통해 진행되었다.
Amplicon sequencing 과정에서 발생한 오류를 교정하기 위해 R(v4.0.3) 프로그램의 DADA2(v1.18.0) 패키지를 활용하였다. 이 과정에서는 Paired-end Read를 대상으로 forward 서열(Read1)과 reverse 서열(Read2)을 각각 265 bp와 217 bp로 자른 후 교정된 시퀀스를 조립하고 DADA2의 Consensus method를 활용하여 amplicon sequence variant(ASVs)를 생성하였다. 또, 미생물 군집 비교 분석을 위한 정규화 과정은 QIIME2(v2022.2) 프로그램을 활용하여 수행되었다. 각 ASV 시퀀스는 가장 유사한 미생물에 대한 taxonomy 정보를 할당하기 위해 NCBI 데이터베이스에서 BLAST+(v2.9.0)을 적용하였다. 다양한 장내 미생물 군집을 비교 분석하기 위해 QIIME2를 사용하여 ASV의 풍부도 및 분류 정보를 사용하였다. 각 샘플 내 미생물 군집의 종 다양성 및 균일성을 확인하기 위해 alpha diversity 분석(Chao 1, Shannon 지수, Simpson)을 수행하였다. 사료 내 미세조류 첨가 효과로 인한 장내 미생물 변화는 Huttenhower Lab Galaxy Server 2.0에서 Linear discriminant analysis Effect Size(LEfSe)(http://galaxy.biobakery.org/)를 실행하여 linear discriminant analysis(LDA) score를 확인하였다. 각 처리군과 대조군 간의 유의한 차이(P<0.05)를 분석했으며, LDA score가 2.0 이상인 taxa가 선택되었다. Predicted KEGG Pathway 분석을 진행하기 위해 PICRUSt2(v2.5.1)소프트웨어를 활용하여 기능을 가진 유전자의 정보를 분류하였다.
미세조류를 첨가한 산란계의 장내 면역세포와 장내 미생물 다양성에 대한 결과를 La Jolla, CA, USA의 Graph Pad 사의 Prism 8 software를 활용하여 통계적으로 분석하였다. 정규분포를 따르는 결과는 two-tailed unpaired t-test를 사용하여 분석하였고, 정규분포를 따르지 않는 결과는 two-tailed Mann-Whitney 검정을 통해 분석하였다. 모든 통계분석에서 유의성은 0.05<P<0.1일 경우 경향성이 있다고 판단하고, P<0.05일 경우 유의하다고 판단하였다. 모든 실험 데이터는 평균±표준 편차로 표시되었다.
결과 및 고찰
미세조류 첨가 급여에 따른 산란계의 산란성적에 미치는 영향을 분석하기 위하여 대조군(CON 그룹)과 미세조류 처리군(MP 그룹)이 생산하는 계란 생산성과 품질에 대한 조사를 실시하였다. 미세조류가 첨가된 사료를 섭취한 산란계의 일일 사료섭취량(feed intake)이나 사료요구율(feed conversion ratio, FCR)은 차이가 나지 않았다(Fig. 1A). 하지만 CON 그룹 대비 MP 그룹에서 난중(egg weight, g)과 산란량(egg mass, g/day)이 유의적으로 증가하는 결과를 확인하였다(Fig. 1B). 이와 유사하게 산란계 사료 내 미세조류(Chlorella vulgaris) 첨가 시 계란 생산성 및 품질을 증가시키는 등의 긍정적인 효과를 가진다고 보고된 바가 있다(Halle et al., 2009).
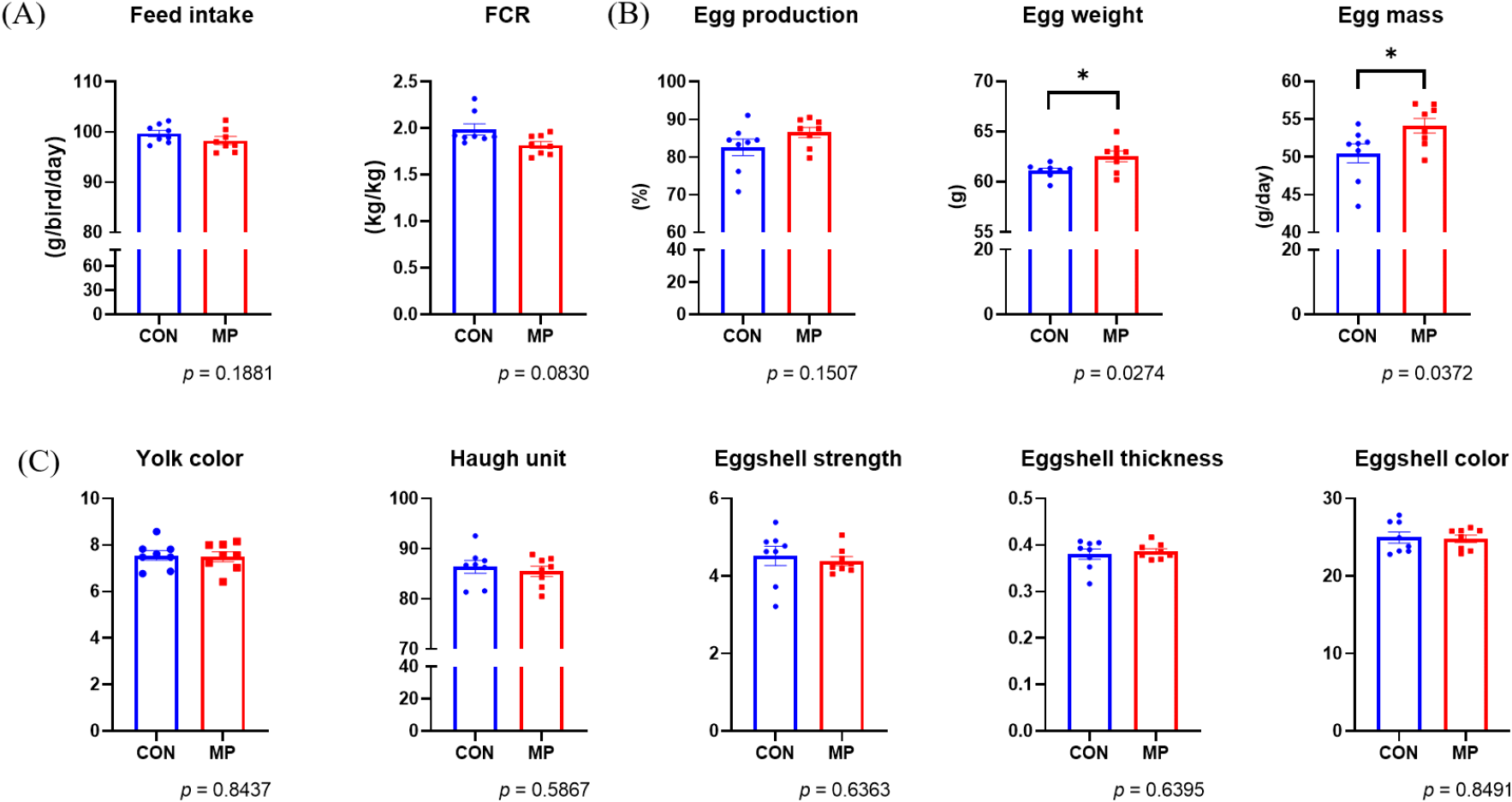
미세조류 첨가가 계란의 품질에 영향을 미치는지 확인하기 위하여 난황 색, 호유닛, 난각 강도, 난각 두께, 난각 색 등을 추가적으로 분석하였으나, 통계적으로 유의한 결과를 확인하지는 못하였다(Fig. 1C). 그러므로, 산란계 사료 내 미세조류(MP) 첨가는 산란계의 계란 생산성에 긍정적인 영향을 미치는 것으로 보인다. 그러나 미세조류를 구성하는 단일 성분이 산란계의 사양 성적 및 장관 면역에 미치는 영향에 대한 연구는 더 필요할 것으로 보인다.
Lamina propria(LP)는 장관 점막 조직 기저에 위치한 얇은 결합조직층이다(Pabst and Bernhardt, 2010). 장 내강에는 음식물, 병원균, 장내 미생물 등 다양한 외부요인이 존재하고 이들에 노출될 시 즉각적인 반응을 유도하기 위하여 LP 내에 T 세포(T cell), B 세포(B cell), 항원제시세포(antigen presenting cells, APCs) 등 다양한 면역세포가 존재한다고 알려져 있다(Varol et al., 2010). 사료 내 미세조류(Mychonastes pushpae, MP) 첨가에 따라 장관 내 면역세포가 변화하는지를 분석하기 위해 닭의 공장 LP 내 면역세포를 분리하여 유세포 분석(flow cytometry)을 실시하였다(Fig. 2). 사료 내 미세조류 혹은 미세조류 유래 추출물(astaxanthin)을 첨가한 사전 연구에서는 CD4+ T cell이 증가하는 효과가 있다고 보고가 되어있다(Kwak et al., 2011; Rim et al., 2022). 그러므로 우리는 먼저 장관 내 면역세포에서 전체 T cell의 비율을 확인하기 위해 T cell의 pan-biomarker인 CD3를 사용하였다. 그 다음 T cell subset인 CD4+ helper T cell, CD8+ cytotoxic T cell, TCR γδ+ T cell의 비율을 확인하였다. Flow cytometry 분석 결과, CON 그룹 대비 MP 그룹에서 CD3를 발현하는 T cell 전체의 비율이나 CD3+ 내 subset인 CD3+CD4+ helper T cells와 CD3+CD8+ cytotoxic T cells, CD3+TCR γδ+ T cells에는 유의적인 차이가 없었다. 하지만 TCR γδ+ T cell 내 subset에서는 차이가 발견되었는데 사료 내 미세조류(MP) 첨가 시 CD8-TCR γδ+ T cells는 유의미하게 증가하였다(Fig. 2C, P<0.05). 닭의 장 점막 내 T cell에는 CD4+ helper T cell, CD8+ cytotoxic T cell, TCR γδ+ T cell로 구성된다. 이 중 CD4+ helper T cell은 주요 조직 적합성 복합체(major histocompatibility complex; MHC) MHC Ⅱ를 발현하는 APC와 결합해 비내인성 항원을 제공받고, 이를 B cell에게 전달하여 항체를 생산하게 한다. 더불어 면역계에서 신호 물질로 작용하는 사이토카인을 분비하여 전체적인 면역 반응을 조율한다(Arstila et al., 1994; Chen and Jensen, 2008). CD8+ cytotoxic T cell은 내인성 항원과 관련된 MHC Ⅰ과 반응하여 세포 독성 기능을 담당한다고 알려져 있다(Erf et al., 1998). TCR γδ+ T cell은 인간이나 쥐와는 달리 닭에서 특이적으로 많은 비율을 차지하는 면역세포이며, 종이나 성별, 연령에 따라 순환 T cell의 50% 비율에 육박할 수 있다고 알려져 있다(Sowder et al., 1988). 주로 혈액이나 비장, 장 점막층에 위치하는 TCR γδ+ T cell은 MHC와의 반응과 관계없이 감염이나 cytokine 자극원에 빠르게 반응하여 광범위한 사이토카인을 분비하고 감염되었거나 변형된 세포를 대상으로 독성을 띤다고 알려져 있다(Shiromizu and Jancic, 2018). 예를 들어 닭에게 Marek’s disease virus를 감염시킨 연구에서는 비장 내 TCR γδ+ T cell의 수가 증가했으며, 감염 단계별로 전염증성 사이토카인인 인터페론-γ(Interferon-γ, IFN-γ)와 항염증성 사이토카인인 인터루킨-10(inteleukin-10, IL-10)의 발현량이 증가하였음이 보고된 바 있다(Fenzl et al., 2017). 닭의 TCR γδ+ T cell은 CD4+, CD8+, CD4-CD8- double negative로 나뉘는 것으로 알려져 있다(Bucy et al., 1991). 쥐의 경우, 흉선에서 CD4-CD8- double negative 상태인 thymocytes가 분화를 거치면서 CD4+CD8+ double positive, 이후 CD4+ 혹은 CD8+ single positive 형태의 최종적인 TCR γδ+ T cell이 생성된다고 알려져 있다(Kadivar et al., 2016). 하지만 닭을 비롯하여 동물의 체내 CD8-TCR γδ+ T cell의 면역학적 기능에 대한 연구는 아직 미흡하므로 사료 내 미세조류(MP) 첨가가 산란계의 TCR γδ+ T cell이 수행하는 기능에 어떠한 영향을 미치는지에 대해서는 추가적인 연구가 필요하다. 또한 사료 내 미세조류(MP) 첨가를 통한 산란계의 장관 면역 변화의 기능성 특성을 파악하기 위해서는 실제적인 사육 환경 조건을 반영한 감염 모델을 적용하여 질병 저항성과 연관된 데이터를 만들어 낼 필요가 있을 것으로 생각된다.
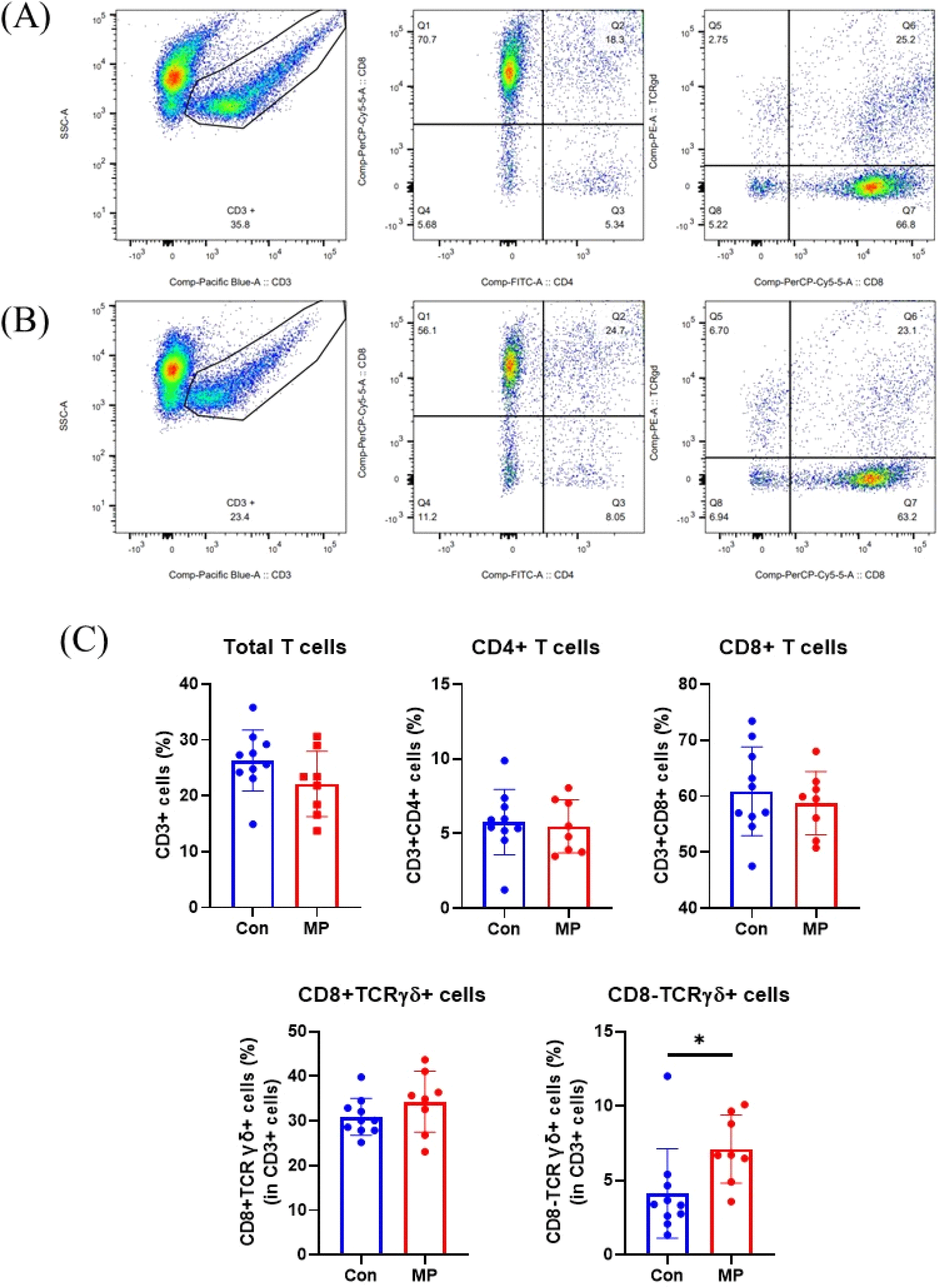
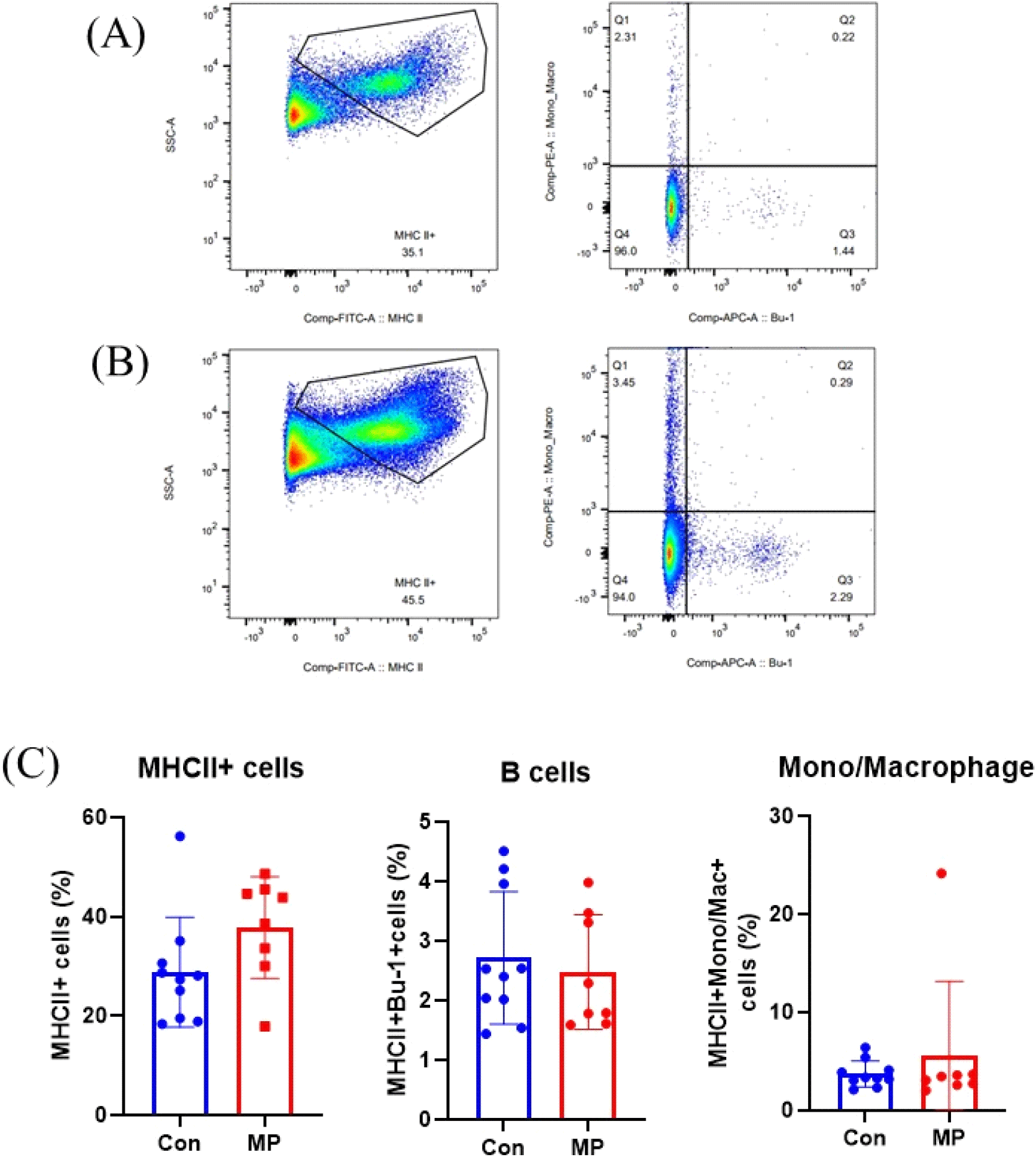
APC는 선천성 면역뿐 아니라 적응면역의 시작을 담당하는 중요한 면역세포이다. APC에는 B cell, 대식세포(macrophages), 수지상세포(dendritic cells, DCs)가 속하며 MHC 분자를 통해 항원을 세포 표면에 제시하여 T cell의 후천성 면역 반응이 일어나도록 유도한다(Weaver and Unanue, 1990; den Haan et al., 2014). APC는 전문성 혹은 비전문성으로 나뉘는데 MHCII를 발현하는 세포는 전문성 APC라 불린다(Kambayashi and Laufer, 2014). 전문성 APC는 식균작용을 통해 병원균을 섭취하고, 세포 내 소화 후 T cell에 항원을 제시하는 중요한 역할을 한다(Schuijs et al., 2019). B cell은 항원에 대응하는 항체를 생성한다는 점에서 중요한 면역 기능을 수행한다(Masteller and Thompson, 1994). 또한 일부 B cell은 기억세포로 분화하여 동일한 병원체 침입 및 이로 인한 같은 항원을 제공받았을 때 더 빠르게 항체를 생산하는 기억반응을 담당한다(Kurosaki et al., 2015). 닭은 포유동물에 비해 생성할 수 있는 항체의 다양성이 적다고 알려져 있으므로 닭의 면역에서 효과적인 B cell 반응의 중요성이 제안된 바 있다(Reynaud et al., 1985; Thompson and Neiman, 1987; Reynaud et al., 1989). Macrophages는 대식작용을 하는 단핵구로서 선천성, 후천성 면역에 중요한 역할을 한다(He et al., 2011). 닭의 경우 macrophages는 바이러스, 미생물, 기생충으로 인한 감염성 질병에 대응하여 전염증성 사이토카인과 케모카인, 활성산소종 등을 생산하는 등의 역할을 수행한다. 본 연구에서는 MHC Ⅱ를 통해 장관 내 전체 면역세포 중 APC가 차지하는 비율을 확인하였으며, B cell의 바이오마커인 Bu-1과 macrophage의 바이오마커 Mono/Mac으로 APC 중 각각의 마커를 발현하는 특정 면역세포의 비율을 분석하였다. 그 결과, 사료 내 미세조류(MP) 첨가 시 CON 그룹 대비 MP 그룹에서 MHC Ⅱ를 발현하는 APC의 비율이 증가하는 경향을 보였으나 유의적인 수준은 아니었다. 또한, B cell과 macrophage의 비율에서는 두 그룹 간의 유의적인 차이가 나타나지 않았다(Fig. 3C). 정리하면, 산란계 사료 내 미세조류 첨가는 장관 면역세포 중 특히 CD8-TCRγδ+ T cells의 증가를 유도하는 기능이 있는 것으로 사료된다.
장내 미생물은 영양, 대사, 면역 등 여러 생리적 기능을 조절하여 숙주의 건강을 유지하는 데 필수적인 역할을 하고 있다(Diaz Carrasco et al., 2019). 장내 미생물 군집 구성과 다양성은 닭의 영양대사 과정과 밀접하게 연관되어 있으며, 이는 사료 소화율, 영양소 흡수, 그리고 에너지 생산 등과 같은 소화능력에 영향을 미칠 수 있다. 또한, 장내 미생물은 소화되지 않는 식이성분으로부터 에너지를 공급하고 장 통과, 에너지 섭취 및 에너지 소비에 영향을 미치는 등 다양한 메커니즘을 통해 숙주의 에너지 균형에 영향을 미친다고 보고된 바가 있다(Flint et al., 2012). 또한 장내 미생물은 병원균의 장관 내 정착을 방해하는 선천성 면역의 기전을 수행할 뿐 아니라 다양한 미생물 유래 신호를 발생시켜 장관 면역의 발달과 정상적 기능에 중요한 역할을 담당한다. 예컨대, 장내 미생물은 동물의 출생 때부터 숙주와 공생관계를 형성하고, 숙주가 섭취한 영양분을 이용해 단쇄지방산(short chain fatty acids)과 같은 장내 미생물 유래 대사체를 생산한다. 이 대사체는 과도한 염증 반응을 제어해주는 등 장관 면역의 항상성 유지 조절에 도움을 준다(Vinolo et al., 2011). 따라서, 장내 미생물 군집은 병원균에 대한 보호, 식이성분 소화, 면역 반응 조절과 같은 다양한 기능을 통해 숙주의 항상성 유지에 매우 중요한 역할을 담당한다.
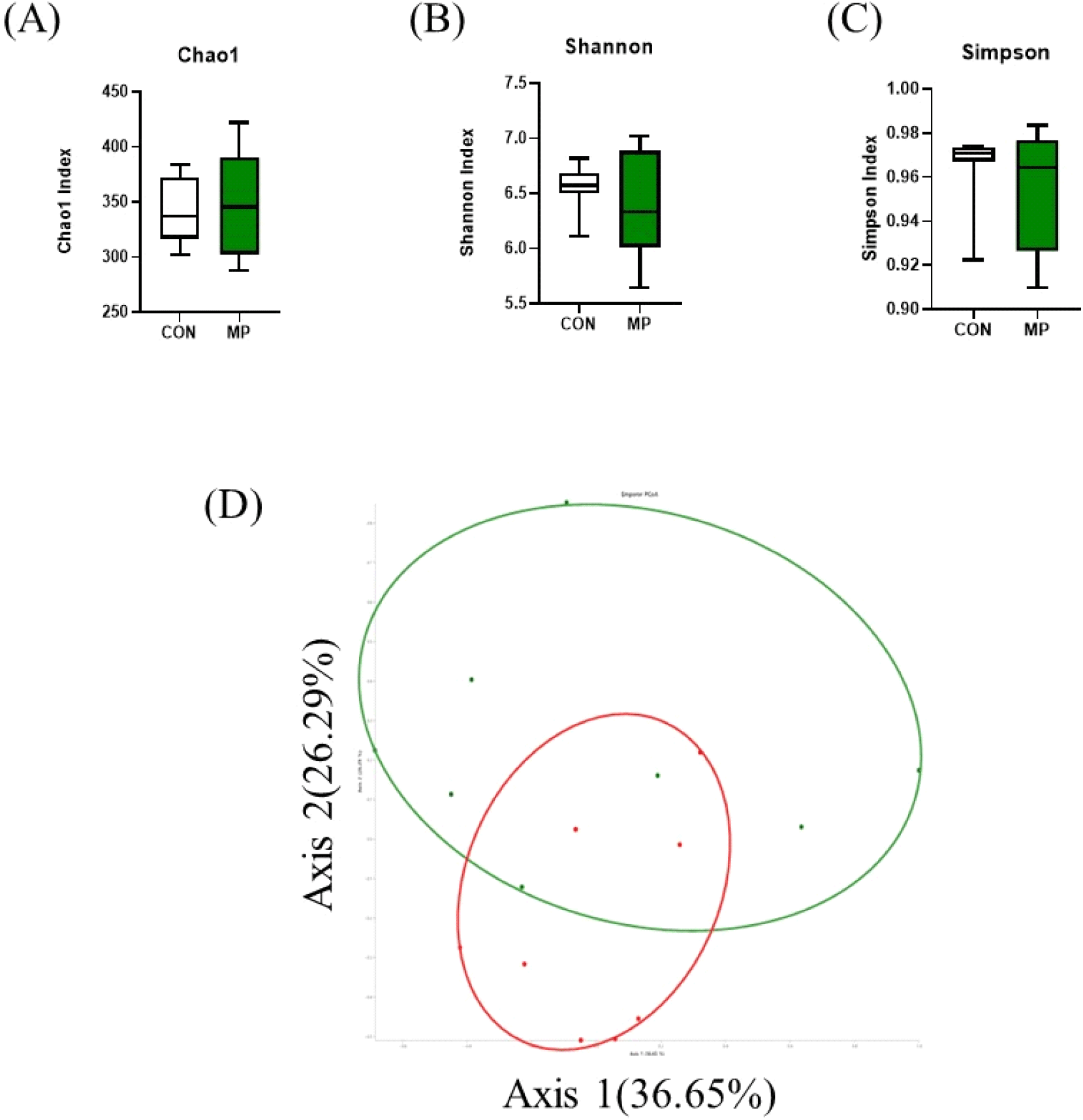
본 연구에서는 사료 내 MP 첨가 시 산란계 맹장 내 분변의 장내 미생물 변화를 조사하기 위하여 16S rRNA sequencing을 수행하였다(Figs. 4 and 5). 먼저 사료 내 미세조류(MP) 첨가에 따른 장내 미생물 군집에 대한 풍부도 및 다양성에 미치는 영향을 조사하기 위하여 Chao1, Shannon, Simpson index를 사용하여 알파 다양성 분석을 진행하였다(Fig. 4). 분석 결과 장내 미생물 군집의 종 다양성 및 풍부도에서 CON 그룹과 MP 그룹 간의 유의미한 차이를 확인하지는 못하였다(Figs. 4A, 4B and 4C). 또한, CON 그룹과 MP 그룹 간의 장내 미생물 군집의 차이를 분석하기 위해 베타 다양성 분석을 실시하였다(Fig. 4D). 베타 다양성 측정값은 주성분 분석(PCA Plot)으로 제시되며 그룹은 두 가지 주요 구성 요소(PC; PC1 – 36.65, PC2 – 26.29%)로 나뉘었다. 분석 결과, 알파 다양성 분석에서는 차이가 없었지만 CON 그룹과 MP 그룹 사이의 베타 다양성 분석에서는 클러스터링의 변화를 통해 MP 첨가 시 장내 미생물의 일부 변화함을 확인하였다. 이는 사료 첨가제 급여에 의해 장내 미생물 균총이 영향을 받았다는 것을 의미한다.
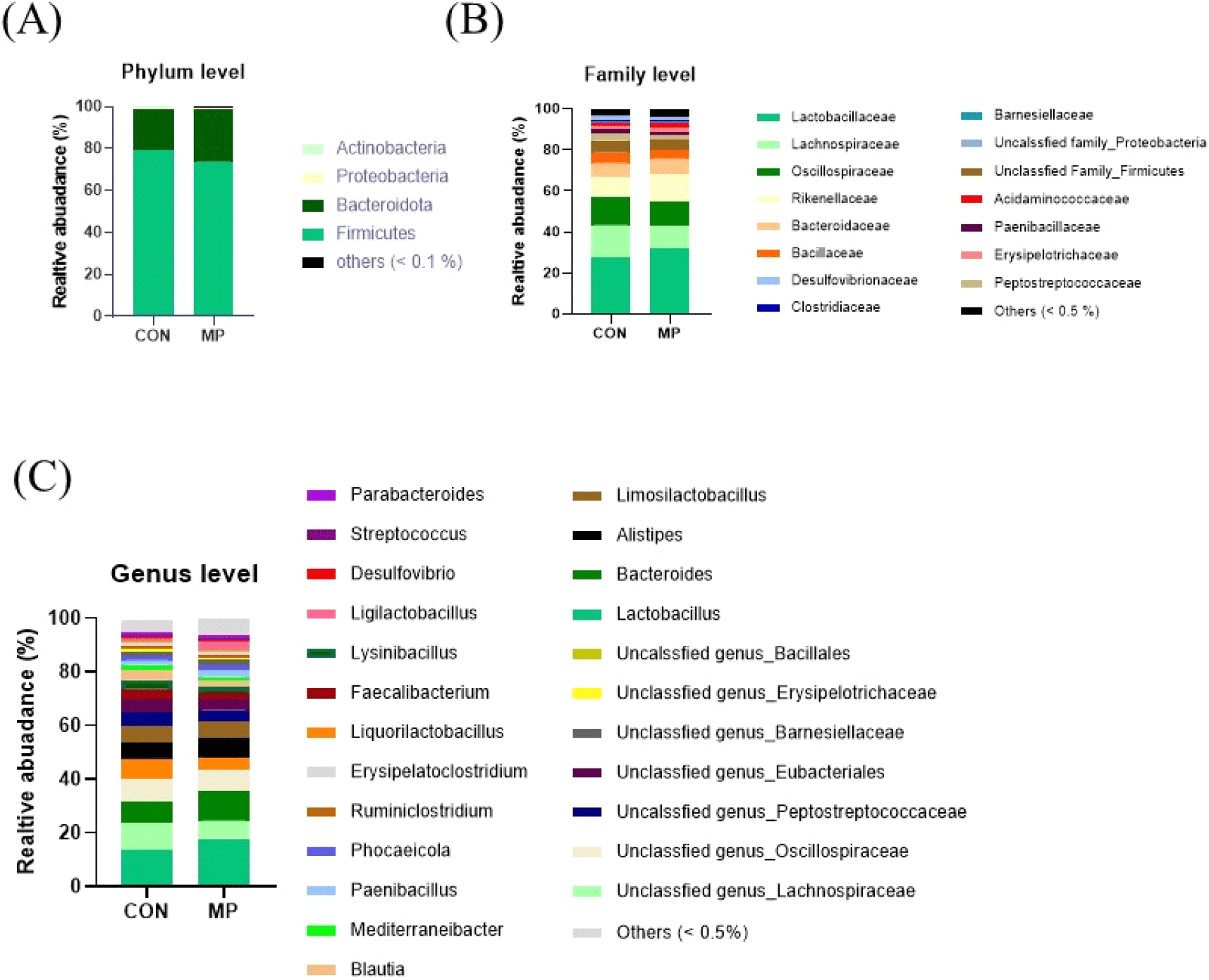
다음으로 맹장 장내 미생물 조성의 차이를 분석하였다. 맹장 내 미생물 균총 분류학적 분포 분석 결과, 생물학적 분류 중 Phylum(문)수준에서 Firmicutes, Bacteroidota, Proteobacteria, Actinobacteria 순으로 나타났으며, 이는 닭의 맹장 내 미생물 군집을 분석한 선행 연구 결과와 일치하였다(Oakley et al., 2014). MP 첨가의 효과를 분석한 결과 CON 그룹 대비 MP 그룹에서 Firmicutes의 비율이 6% 감소하였고, Bacteroidota의 비율이 7% 증가하였다(Fig. 5A). 생물학적 분류 단계 중 Family(과)단계에서 균총을 분석한 결과, Lactobacillaceae, Lachnospiraceae, Oscillospiraceae, Rikenellaceae가 약 60% 이상을 차지하였다(Fig. 5B). 유익균을 많이 포함하고 있는 Lactobacillaceae가 CON 그룹에서 27.56%, MP 그룹에서 32.16%로 분포하여, 미세조류(MP)를 급여하였을 때 상대적으로 증가하는 것을 확인하였다. Rikenellaceae의 분포도는 MP 그룹에서 13.09%로 CON 그룹의 9.84%에 비해 증가하였다. 유사 연구에서도 육계의 사료 내 식물 추출물 첨가 시, 맹장 내 Rikenellaceae의 풍부도 변화가 관찰되었다(Zhu et al., 2019). Rikenllaceae는 Bacteroidales 계열의 균주로 맹장 내 미생물 군집의 중요한 구성원으로서 장 건강을 유지하는 데 중요한 역할을 할 뿐만 아니라 다양한 대사활동과 상호작용을 통해 숙주의 건강을 유지하고 조절하는 데 중요한 역할을 한다고 보고된 바가 있다(Chen et al., 2020). Genus(속) 단계에서 산란계 맹장 내 미생물을 분석한 결과, Lactobacillus, Unclassfied genus_Lachnospiraceae, Bacteroides, Unclassfied genus_Oscillospiraceae, Limosilactobacillus가 약 50% 이상을 차지하였다(Fig. 5C). 유익균을 많이 포함하고 있는 Lactobacillus가 MP 그룹에서 16.89%로 CON 그룹 13.58%에 비해 증가하는 것을 관찰하였다. 마찬가지로, Lactobacillaceae 계열 균주인 Limosilactobacillus의 분포도는 CON 그룹에서 5.8%, MP 그룹에서 6.68%로 미세조류(MP)를 급여하였을 때 상대적으로 증가하는 경향을 나타내었다. 또한, Oscillospiraceae 계열 균주인 Faecalibacterium는 MP 그룹에서 4.03%로, CON 그룹 3.49%에 비해 증가하는 경향을 확인하였다. Faecalibacterium은 동물의 장관에서 중요한 부티르산(butyric acid) 생산자 중 하나이며, Faecalibacterium prausnitzii는 항염증성, 세균 효소 활성 유지, 장내 병원균으로부터 소화기를 보호하는 기능을 가졌다고 보고된 바가 있다(He et al., 2023). 이는 가금류 사료 내 셀레늄 나노 입자 첨가를 통해 단쇄지방산(SCFA)의 풍부함을 증가시켜 장 건강을 개선한다고 알려진 Lactobacillus 및 Faecalibacterium의 증가와 결과가 일치하였다(Gangadoo et al., 2018).
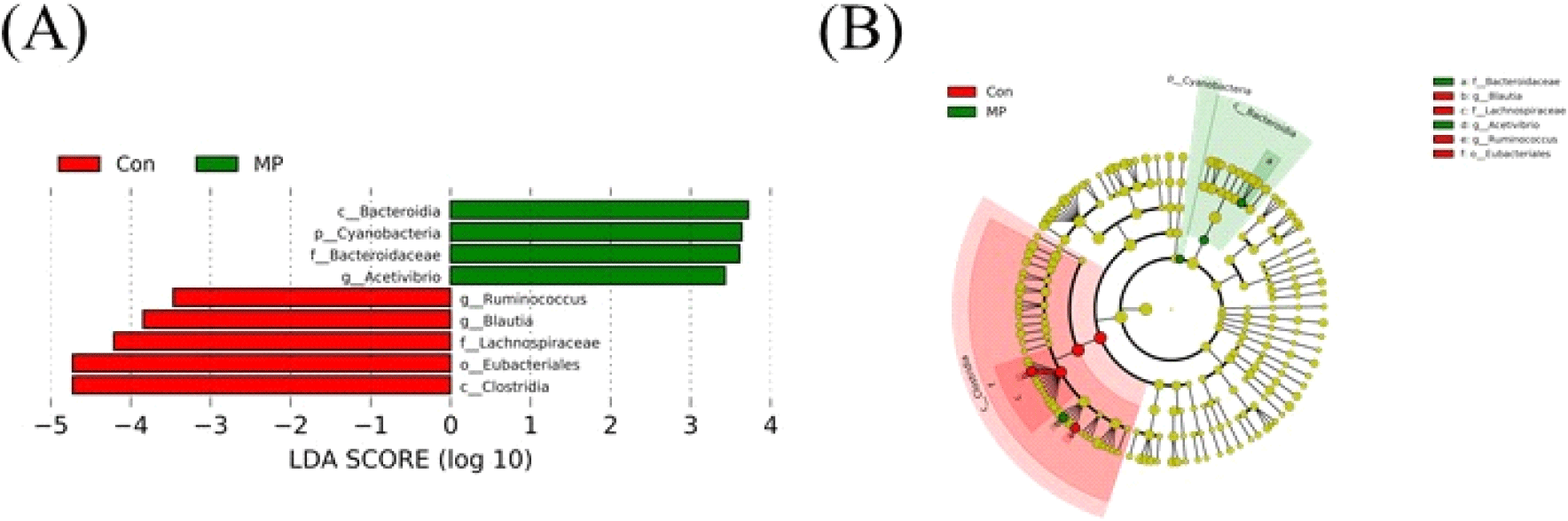
산란계 사료 내 미세조류(MP) 첨가 시 장내 미생물의 분포 중 유의적으로 차이가 나는 특징적인 균주를 조사하기 위해 LEfSe 분석을 추가적으로 실시하였다(Fig. 6). Unclassfied 균주는 제외하고 LDA score>2, P<0.05에 해당하는 OTU를 선별하여 분석한 결과, 미세조류(MP) 급여 시 일부 미생물 균총이 증가하는 것을 관찰하였다(Figs. 6A and 6B). 그 중 Acetivibrio는 Clostridia Class(강) 단계에 속하는 균주로, 다당류를 분해하여 아세트산을 생성함으로써 장내 환경을 유지하는 데 도움을 줄 수 있다(Zenner et al., 2021). 아세트산은 닭의 장내 pH 안정화에 도움이 되고 유익한 미생물의 성장을 촉진하는 등 닭의 소화 장관에서 매우 중요한 역할을 하는 미생물 중 하나이다. 또한, 다당류와 같은 복잡한 탄수화물의 분해는 소화과정을 원활하게 하고. 닭이 섭취한 식품의 영양소를 더 효과적으로 이용할 수 있도록 도움을 준다(Patel et al., 1980). Bacteroidota의 계열인 Bacteroidia, Bacteroidaceae는 닭의 맹장 내에서 가장 흔한 군집 중 하나이다. Bacteroidaceae의 유전체에는 복잡한 다당류를 분해하는 데 필요한 유전자가 풍부하며, 이는 다양한 탄수화물을 효과적으로 분해하는데 도움을 줄 수 있다. Bacteroidaceae 균주는 Lactobacilli 균주와 영양 배지를 동일하게 산성화시킬 수 있는 능력을 가지고 있어 닭의 장내 발효 및 유기산 생성에 중요한 역할을 한다고 알려져 있다(Rychlik, 2020).
다음으로 본 연구에서는 CON 그룹과 MP 그룹의 장내 미생물군 기능성 유전자의 풍부도를 PICRUSt 2를 이용하여 분석하였다. 총 29종류의 기능성 유전자 풍부도가 변화하였으며, 이 중 CON 그룹 대비 MP 그룹에서 4종류의 기능성 유전자 풍부도가 증가하였고 나머지 25종류는 대조군 대비 처리군에서 감소한 것으로 나타났다. 불포화 지방산 생합성은 CON 그룹 대비 MP 그룹에서 증가하였고, 반대로 미생물 주화성 및 닭의 장내 상피조직에 대장균이 붙어 서식하는 미생물막의 형성 기능과 연관된 유전자 풍부도는 감소한 것으로 나타났다(Fig. 7). 지방산은 일반적으로 메틸기와 카복실기가 붙은 탄소 결합 사슬로 구성되는데, 이 중 결합의 유무에 따라 포화 지방산과 불포화 지방산으로 구분된다(Roche, 1999). 이전부터 불포화 지방산은 인간의 비만이나 자가 면역 질환, 만성 질환, 염증 혹은 면역 반응 제어 등 생체 면역 활동과 매우 깊은 연관이 있다고 보고되었다(Calder and Grimble, 2002; Simopoulos, 2008; Machate et al., 2020). 예로부터 달걀의 난황 내 불포화 지방산 함유량은 산란계의 산란성적을 살펴보는 지표로 이용되어 왔다(Wang et al., 2000). 이에 사료 첨가물을 비롯한 다양한 방법을 이용하여 난황 내 불포화 지방산의 함유량을 높이려는 연구가 수행되어 왔다(Hwangbo et al., 2005; Kang et al., 2013; Omidi et al., 2015; Wu et al., 2023). 사전 연구에 따르면 산란계의 사료에 갈조류를 첨가하여 급여하였을 때 난황 내 불포화 지방산의 함량이 증가되었다고 보고했다(Jo, 2014). 본 연구에서 사료 내 미세조류(MP) 첨가에 의해 장내 불포화 지방산의 생합성이 증가하였으므로 난황 내 불포화 지방산 비율 증가로 인한 달걀 품질의 향상을 기대해볼 수 있을 것으로 사료된다.
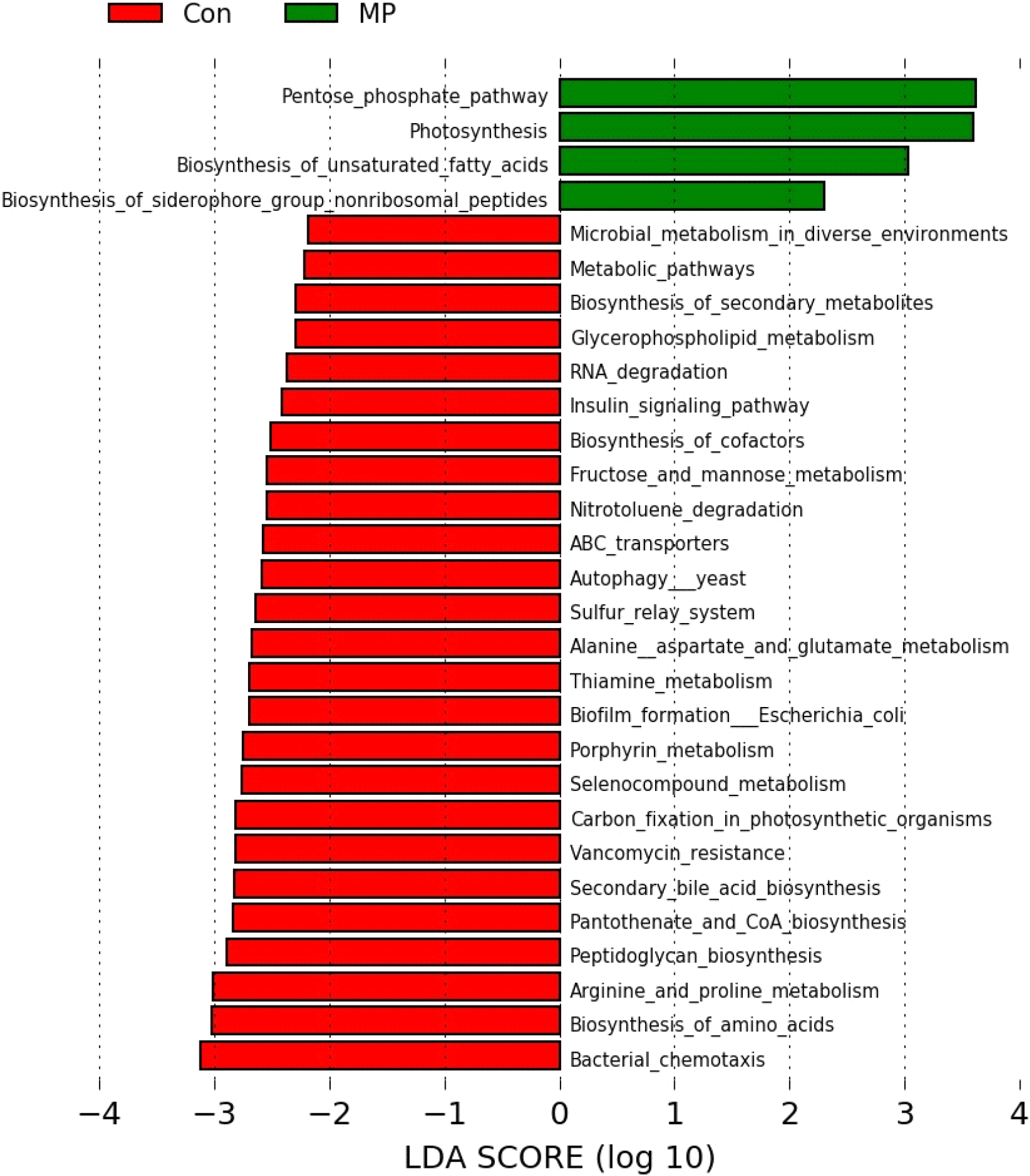
미생물의 주화성이란 다양한 화학적 환경 신호에 의해 미생물이 선호하는 환경으로 이동하는 성질을 일컫는다(Matilla and Krell, 2017). 장내 미생물 중 Escherichia coli(E. coli) 0157:H7와 같은 병원성 미생물은 닭의 장관에 서식하면서 질병을 일으키며, 오염된 달걀을 매개로 인간에게 전파된다(Armstrong et al., 1996; Nguyen and Sperandio, 2012). 이에 사전 연구에서는 비타민 E 및 A를 급여하여 E. coli 감염으로부터 닭의 면역 저항성을 증강시키고자 하였다(Tengerdy and Nockels, 1975). 사료 내 미세조류(MP) 첨가에 의해 CON 그룹 대비 MP 그룹에서 장내 미생물의 주화성이 감소한 것으로 보아, 닭의 장내 서식하는 병원성 미생물이 장 상피조직으로 침투할 가능성을 낮춰 산란계의 안전성을 향상시킬 수 있을 것으로 사료된다.
병원성 혹은 공생 미생물은 숙주의 면역 방어 및 환경 변화, 항균 물질에 대응하여 급격한 변화에 적응할 수 있어야 한다. 따라서 숙주 세포 바깥에 조직화된 집합체를 형성하는데, 이것을 미생물막(bacterial biofilm)이라고 한다(Jefferson, 2004). 미생물 감염의 약 65%가 이 bacterial biofilm과 연관되어 있다고 알려졌다(Jamal et al., 2018). E. coli에 의해 형성되는 biofilm은 닭의 장내 영양분 흡수 저하, 염증 발생과 같은 다양한 문제의 원인 중 하나로 지목된다(Ding et al., 2022). 더불어 닭의 장내에 서식하는 E. coli에 의해 생성된 biofilm은 인간에게 전달되어 장내 염증을 일으킬 수 있는 원인으로 작용할 수 있다고 보고된 바 있다(Levy et al., 1976; Caudry and Stanisich, 1979). 따라서 닭의 장내 병원성 미생물의 biofilm 생성 저하를 통해 닭의 장 건강을 향상시킬 수 있고, 식품 안전성을 보장할 수 있다. 사료 내 미세조류(MP) 처리에 의해 CON 그룹 대비 MP 그룹에서 E. coli의 biofilm 형성과 관련된 유전자 풍부도가 저하된 것을 고려할 때 미세조류(MP)가 닭의 장내에 서식하는 병원성 미생물의 활동을 감소시키는 데 기여할 것으로 생각된다. 하지만 미세조류(MP) 급여에 의한 유해균 증식이나 침투와 같은 장 건강 관련 항목에 대한 추가적인 분석이 요구된다. 또한 안전한 계란 생성과 연관된 다양한 지표들과 연관하여 추가 연구가 진행된다면 사료 첨가제로서 미세조류의 광범위한 활용 가능성을 제시할 수 있을 것으로 보인다.








