서 론
가금 산업은 인류에게 효율적인 고품질의 동물성 단백질을 공급함으로써 동물산업에서 중요한 위치를 차지하고 있다. 육계의 빠른 성장, 짧은 세대 간격은 타 경제 동물들에 비하여 큰 이점이 있다고 하겠다. 현대 상업용 육계의 빠른 성장과 근육량 증가는 육종의 놀라운 성과의 결과이다. 하지만 생산성이 높은 오늘날의 육계는 동물이 가진 생리적 한계에 가까워졌음을 의미하며, 과도한 지방 축적은 육계 산업에 중대한 문제로 부상하고 있다. 이는 살코기 수율과 사료 효율성의 감소뿐만 아니라, 소비자들에게도 부정적인 영향을 미칠 수 있다. 복부지방이 특히 문제로 부각 되어 있는데, 지방 축적은 살코기 생산에 비하여 3배 이상의 에너지 소비량이 증가하고 생산비 증가 등의 문제를 야기한다(Jiang, 2010). 현재 많은 국가에서 산란계를 생후 100주까지 사육하고, 생산주기 동안 평균 개체당 500개 이상의 알을 생산한다(Bain et al., 2016; Preisinger, 2018). 산란계가 높은 생산성을 유지할 수 있는 것은 육계와 마찬가지로 유전과 육종에 기반한 선발의 결과로 볼 수 있다. 생산성이 높은 산란계는 계란을 생산하는데 필요한 영양소(에너지원, 단백질, Ca, P 등)를 생리적으로 지원해야 한다. 그 중에서 난황의 지방 축적은 산란계에서 매우 중요한 생리적 대사 과정이다. 가금의 지질 대사에서 중요한 지질단백질은 조류에서 노른자와 체지방 축적을 위한 필수적인 구성 요소로 작용한다(Alvarenga et al., 2011). 지질단백질과 그들의 대사를 이해하는 것은 연구자들에게 건강하고 더 생산적인 동물 개발에 도움이 될 수 있으며, 이를 통해 농장주들에게 경제적 이익, 그리고 소비자들에게 높은 영양적 품질을 제공함으로써 인류 건강을 향상시킬 수 있다. 이에 가금에서 식이 지방의 운송, 간에서의 지방산 생합성, 복부와 근육 내 지방 축적, 그리고 지질의 난황 축적 등에 대한 생리적 측면을 살펴보고, 가금에서 지방 대사 조절에 대한 최근까지의 연구 동향을 소개하고자 한다.
본 론
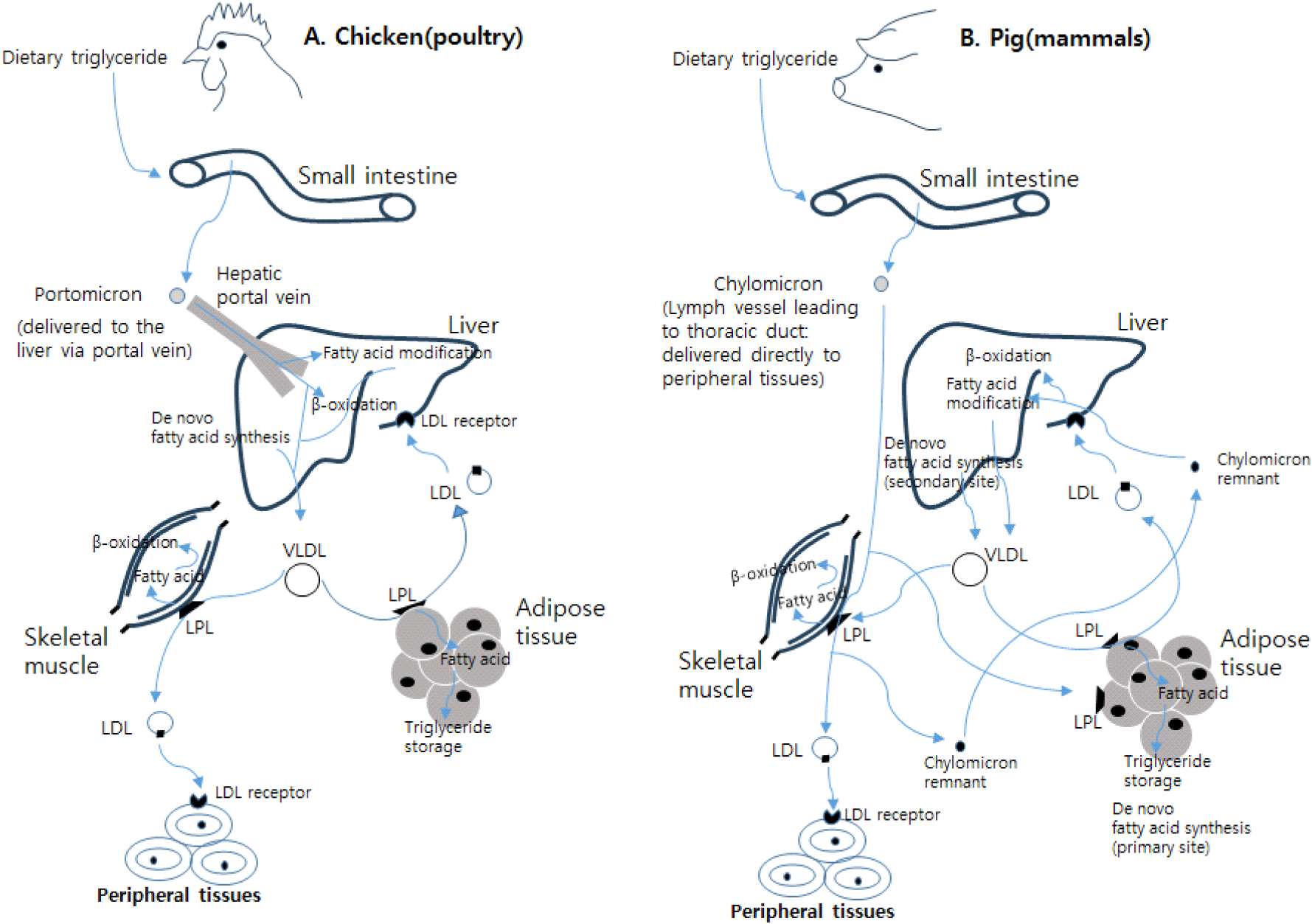
포유류과 조류의 지방 대사 생리에서 가장 큰 차이점 중 하나는 식이 지방의 장내 소화 후 간으로 운송하는 과정이다. 포유동물에서 섭취된 지방은 장에서 지방산으로 가수분해 및 흡수과정을 거처 다시 중성지방으로 재조립되고, 이후 림프계와 혈류로 방출되는 지단백질 chyromicron에 통합된다(Butler et al., 1975; Wang et al., 2013; Moon, 2018). 혈관 순환계에 유입된 chyromicron은 지방산을 주변 조직에 직접 전달한다(Fig. 1). 잔존 chyromicron(chyromicron remnant)은 이후 간에서 흡수되며, 특정 지방산들은 VLDL(very low density lipoprotein)에 편입되기 전에 새로 합성된 지방산들과 함께 변화된 후 VLDL에 합류한다. 조류에서 흡수된 지방산은 큰 지단백질(lipoprotein: portomicron)에 통합되며, 이는 문맥계(hepatic portal vein)에 방출되어 바로 간으로 이동한다(Williams and Buck, 2010) (Fig. 1). 이와 같은 이유는 조류의 위와 하부소화 장기의 장관 림프계가 포유류에서 볼 수 있는 온전한 림프계가 발달되어 있지 않기 때문이다(Freeman, 1984). 조류에서 발달된 림프계의 부재는 소장의 융모(villi)에 잘 발달된 혈관망으로 림프계의 부재를 보완한다. 따라서, 조류의 중성지방은 림프계가 아닌 문맥계를 통하여 흡수 및 수송된다(Noyan et al., 1964). 포유동물은 종에 따라 주된 지방합성 장소가 차이가 있지만, 돼지의 경우 지방 조직에서 지방산이 합성되어 지방세포 내에 중성지방 형태로 저장된다. 필요한 경우, 돼지의 지방 조직에서 저장된 중성지방에 lipase의 효소의 도움을 받아 지방산과 글리세롤로 분해된 후 혈류로 방출되고, 혈액 내에서 혈장 단백질인 알부민과 결합하여 근육조직이나 간 등 다양한 주변 조직으로 운반되어 에너지로 사용되거나 저장된다. 중성지방으로 구성된 사료 내 지질의 장내 소화는 부분 가수분해, 흡수 및 장점막 세포에서 매우 큰 지단백질 입자로의 재조립과정을 거친다. 앞에서 언급한 것처럼, 조류는 장내 림프계가 잘 발달 되지 않기 때문에 지단백질이 문맥계로 직접 분비되는데 이를 portomicron이라 한다(Bensadoun and Rothfield, 1972). 식이 유래 지방산은 소장에서 흡수된 후 portomicron의 중성지방 구성원으로서 문맥계에 유입된다. 이 지단백질의 크기(약 150 nm)와 구성(약 90% 중성지방)은 포유류의 chyromicron과 매우 유사하다(Griffin et al., 1982). Portomicron은 사료를 주지 않은 가금의 혈장에는 없으며, 사료를 먹은 부화 초기의 미성숙 병아리의 portomicron 농도는 매우 낮다. 이러한 상황은 대부분 가금류 사료에서 상대적으로 적은 양의 지방함량뿐만 아니라 간의 조직에서 portomicron이 매우 빠르게 분해 작용에 노출되고 있음을 의미한다(Hermier, 1997). 지방은 물에 대한 소수성 특성 때문에 동물의 혈장 및 기타 조직액에서 불용성이다. 이러한 특성으로 인해 지방은 혈액 속에서 지단백질(lipoprotein)의 구성원으로 운반되어야 한다. 조류는 장상피세포(entrocytes)에서 생성되는 portomicron이 지단백질로 혈액순환계를 통하여 소장관(gastrointestinal tract)으로부터 지방을 간으로 수송하는 역할을 한다. 여기서 지단백질에 대하여 좀 더 살펴보면, 지단백질은 지질과 단백질로 이루어진 복잡한 구형 입자들을 말한다. 이러한 입자들은 혈류를 순환하며, 혈장 내에서 내생성(endogenous)과 외생성(exogenous) 지질(콜레스테롤, 중성지방)을 신체 필요조직에 운반한다(Fig. 1). 지단백질은 마이셀(micelles)과 유사한 구조로, 비극성 핵인 중성지방(glycerol ester; triglycerides)과 에스테르화된 콜레스테롤(cholesterol ester)을 포함한 구조체를 포함하고 있으며, 이들은 인지질(phospholipids) 및 유리 콜레스테롤(free choresterol)로 이루어진 단일층(monolayer)으로 둘러싸여 있다. 이 단일층은 입자의 외부 표면을 이루며, 물속 환경과의 상호 작용을 한다. 이 단일층에는 입자 유형에 따라 다양한 아포단백질(apoprotein)이 포함되어 있다. 지단백질 입자들이 전달하는 주요 지질은 중성지방과 콜레스테롤(유리 및 에스테르화된 콜레스테롤)이며, 이들은 식이로부터 얻거나 신생 합성을 통해 획득된 지방산을 포함한다. 닭의 지단백질에는 portomicron 외에 밀도에 따라 VLDL, IDL(intermediate density lipoprotein), LDL(low density lipoprotein), HDL(high density lipoprotein) 등으로 구분한다. 종류가 다른 지단백질 사이에 지질과 apoprotein 교환을 통해 화학적 구성이 상당히 변하기 때문에 같은 지단백질이라도 화학 조성은 다양하다(Alvarenga et al., 2011). 조류는 합성되는 지방산의 약 70%는 간에서, 약 5%는 지방 조직, 나머지 25%는 사료로부터 유래된 것이다(Griffin and Harmier, 1988). 가축화된 포유동물(소, 돼지 등)의 경우 지방산의 생합성은 대부분 지방 조직에서 일어나는 것과 큰 차이가 있다. 사람, 쥐 외 닭, 돼지, 소 등 축종별 지방산 생합성, 축적 등에 대한 정리된 비교표는 ‘닭의 지방대사와 지방간’에서 확인할 수 있다(Moon, 2018). 조류의 경우, 포화 지방산, 단일 불포화 지방산, 다중 불포화 지방산을 포함한 섭취된 지방산들은 소장에서 흡수되며, 중성지방로 전환되어 portomicron에 통합된 후, 간문맥을 통해 간으로 전달된다. 간에서, 식이 지방산은 선택적으로 산화되거나 새로 합성된 지방산과 함께 저밀도 지단백질(VLDL)에 포장되어 일반 혈액순환계에 방출된다. 식이 지방산들은 지방산 사슬 연장, 지방산 포화 등을 거쳐 VLDL에 편입되기 전에 지방산의 형태가 변화될 수 있다. 지단백질의 지방분해효소(LPL)는 VLDL로부터 중성지방을 가수분해시켜 유리 지방산을 생성하고, 이는 주변 조직에 흡수된다. 중성지방이 빠져나간 빈 VLDL은 콜레스테롤이 풍부한 저밀도 지단백질(LDL)로 전환되어 혈관을 따라 순환하며 각 조직의 LDL 수용체를 통해 해당 조직에 흡수된다(Williams and Buck, 2010) (Fig. 1). 따라서 조류와 포유류에 관계없이 VLDL은 주로 간에서 생성되는 지질을 운반하는 수송체임을 알 수 있다.
조류의 지방산 생합성은 포유류와 마찬가지로 동물에게 주로 acetyl-CoA를 제공하기 위한 것이지만, 세포막의 인지질 구성 성분, 그리고 단백질과 복합 탄수화물의 변형에 중요한 기능을 한다(Hillgartner et al., 1995). 따라서 대부분 조직의 세포는 매우 낮은 수준(basal level)의 지방산을 합성하는데, 그 합성의 수준은 사료나 호르몬에 의해 조절되지 않는다(Hillgartner et al., 1995). 반면에, 간과 지방 조직에서 지방산 합성은 다른 조직들과 비교하면 10~1,000배 높게 일어나며, 합성 수준은 식이와 호르몬에 의해 조절된다(Hillgartner et al., 1995). 사람과 조류는 간에서 대부분 지방산을 합성하고, 돼지와 반추동물은 지방 조직이 주된 지방산 합성장소가 되지만, 설치류는 간과 지방 조직 모두에서 지방합성이 높게 일어난다(Hillgartner et al., 1995). 사료로 공급되는 탄수화물의 가용성이 높을수록, 사료 내 지방함량이 낮은 사료를 섭취할수록 지방산 생합성은 높아진다. 앞에서도 언급한 것처럼 조류의 지질 대사는 간 내 지방산 생합성이 다른 대부분의 척추동물에 비해 매우 높다(Griffin and Hermier, 1988; Stevens, 1996; Hermier, 1997). 그러나 이러한 결과는 탄수화물이 풍부한 사료를 소비하는 닭을 포함한 가금류를 중심으로 수많은 연구가 진행되어서 생긴 편견일 수 있다. 이에 반해, 일반 바다새와 같은 조류에서는 간 내 생합성은 낮고 대부분의 지방산 생합성이 지방 조직에서 일어난다(Herzberg and Rogerson, 1990). 바다새와 같은 조류의 경우 물고기가 주요 먹이가 되고, 물고기는 지방이 풍부하게 함유되어 있고 탄수화물이 거의 없으므로 간 내 지방산 생합성 속도는 낮다(Willams and Buck, 2010). 그러나 여기에서는 닭을 중심으로 지방산 합성에 중점을 두고 설명하고자 한다. 조류도 포유류와 마찬가지로 생합성으로 지방산을 생성한다. 그러나, 조류에서 새로 생성되는 지방산의 종류가 포유류와 다를 수 있으며, 새로 생성되는 지방산은 9번 탄소 불포화 활성화 효소(Δ9—desaturase)로 인해 특징적으로 단일 불포화 지방산을 만들 수 있다(Klasing, 1998). 척추동물은 9번 탄소를 기준으로 2개 이상 이중 결합을 포함하는 탄화수소 생성을 위한 활성화 효소를 갖지 않으므로 n-3 및 n-6 지방산은 식이로부터 공급받아야 한다. 그러나 식이성 다가불포화 지방산은 불포화효소(Δ5—desaturase, Δ6—desaturase), 사슬연장, 퍼옥시좀에서 사슬 단축 등을 통해 탄화수소가 변형될 수 있다. 순환하는 VLDL 내의 중성지방에서 LPL에 의해 가수분해되어 유리 지방산과 글리세롤로 방출된다. 절식이나 고강도 운동과 같은 음에너지 균형 상태에서는 지방산이 지방조직 저장소에서 동원되어 에너지 요구를 충족한다. 동원 과정에서 호르몬 감수성 lipase가 중성지방을 글리세롤과 유리 지방산으로 가수분해시키며, 이들은 알부민에 결합하여 혈장을 통해 운반된다. 중성지방 가수분해 경로는 척추동물 전체에 걸쳐 공통적이며, 조류도 다른 척추동물들과 유사한 경로를 사용한다(Stevens, 1996). VLDL과 HDL은 조류의 간에서 합성되고 분비되는 주요한 두 가지 지단백질 형태이다. 지단백질의 특정 구성 성분인 apolipoprotein(apo)도 간에서 합성된다. apoB-100(Siuta-Mangano et al., 1982) 및 apoA1(Banarjee and Redman, 1984)은 각각 닭 VLDL과 HDL의 주요 apolipoprotein이다. VLDL과 관련하여 중성지방, 인지질, 콜레스테롤 및 apoB의 조립은 소포체에서 시작하여 초기 입자가 포장되는 골지체(Golgi complex)에서 끝나고 소포(vesicle)의 형태로 포장되어 분비되는 순차적 과정이다. 닭의 HDL합성 및 분비 경로는 VLDL과 유사한 것으로 알려져 있다. 지질 분비는 적어도 부분적으로 세포 내 구획에서 지단백질의 체류시간과 지질 및 단백질 부분의 가용성에 의해 조절 받는다(Hermier, 1997). 지단백질 조립에서 특정 단백질인 microsomal triglyceride transfer protein(MTP)이 중요한 역할을 한다(Wetterau et al., 1997). 특히 오메가3 계열의 지방산을 포함하는 인지질은 HDL과 주로 연관되어 있다(Hermier, 1997). 콜레스테롤과 인지질을 지질-빈약 아포단백질(apo-A1과 apoE)로 배출하는 데에 ATP-결합-캐셋트전송체(ABC-A1)가 매개 역할을 한다(Mulligan et al., 2003). 조류의 지방산 생합성은 포유류와 마찬가지로 식이성 탄수화물과 아미노산의 이용성에 달려있다. 닭이 사료를 섭취하게 되면 insulin은 지방합성에 관여하는 주요 효소들 즉, malate dehydrigenase, fatty acid synthase, citrate lyase 등의 활성을 촉진하는 반면, glucagon과 adrenalin은 지방산 합성을 억제하는 기능을 한다(Tarlow et al., 1977). 알을 낳기 시작하는 산란계는 estrogen에 의한 작용으로 난황형성(vitellogenesis) 요구가 커짐에 따라 간 내 지방산 합성이 강화된다. 간에서 지방산 생합성을 위한 최대의 활성은 insulin과 estrogen이 합동으로 작용하여 식이성 탄수화물과 아미노산이 균형있는 조합을 갖추었을 때로 본다(Alvarenga et al., 2011). 이는 탄수화물과 아미노산 측면에서 균형 잡힌 사료 공급의 중요성을 강조한다. 호르몬에 의한 제어는 간 내 지방생성의 속도 조절에 중요한 역할을 할 수 있으며, 따라서 닭의 육종과 선발에서 유전적 지표와 관련될 수 있다. 간은 지방산 생합성에 의한 중성지방 생성 외에 콜레스테롤, 인지질 등의 중요한 합성장소이며, 이런 지질들은 단백질등과 함께 lipoprotein의 단일 막 형성의 주성분이 된다(Hermier, 1997).
조류의 중성지방은 간, 지방조직 및 성장하는 난모세포에 저장될 수 있다(Hermier, 1997). 닭의 지방산의 생합성은 지방조직에서 매우 제한적이고 난소에서는 일어나지 않는다(Saadoun and Leclercq, 1987). 따라서 지방조직이나 난소에서의 중성지방의 저장은 섭취하는 사료 또는 간에서 합성된 지방으로부터 유래하는 혈장 지질이 기질이 되기 때문에, 혈장 지질의 수준이 중성지방의 이용 가능성에 영향을 미치게 된다. 시장출하 일령에 도달한 육계의 경우 지방조직에 축적되는 지방산의 약 80~85%는 혈장 지질에서 유래된 것이다(Griffin et al., 1992). 일반적으로 가금의 경우 사료 내 지질은 10% 이하이기 때문에 간은 모든 조직에서 필요한 대부분의 지질을 공급하기 위하여 지방산을 생합성하게 된다. 육계의 지방 축적은 유전적 요인(품종, 성별, 유전자형)과 비유전적 요인(영양, 연령, 환경)의 영향을 받는다(Luo et al., 2022). 지방 침착 속도는 육계의 조직에 따라 다르다. 또한 포도당과 지질 대사 및 호르몬 감수성은 지방세포가 속한 조직에 따라 다양하다(Han et al., 2017). 예를 들면, 복부지방과 근육 내 지방의 침착은 닭에서 다른 메커니즘에 의해 조절되며, 이러한 특성은 높은 근육 내 지방과 낮은 복부지방을 가진 육계의 유전적 선택을 가능하게 한다(Leng et al., 2016: Zhang et al., 2019). 가슴근육 및 복부지방 조직의 전사체 데이터를 차등 발현 분석 결과, GAPDH, LDHA, GPX1 및 GBE1 유전자가 근육 내 지방 침착 조절에 관여하고 FABP1, ELOVL6, SCD 및 ADIPOQ 유전자가 복부지방 침착을 결정하는 것으로 나타났다(Luo et al., 2022). 해당과정(에너지대사)과 포도당 생성 신호 전달 경로는 근육 내 지방 침착에서 중요한 역할을 하는 반면, 지방산 합성 경로 관련 PPAR 대사는 복부지방 침착을 조절한다(Luo et al., 2022). FABP(fatty acid binding protein)은 세포내 지질 결합 단백질의 구성원으로서 장쇄지방산에 결합하여 세포내 소화 및 유동성을 촉진, 지방산 수송, 세포성장, 세포신호전달등 중요한 역할을 한다(Moreno-Vedia et al., 2022). 장쇄지방산은 다양한 세포 소기관(미토콘드리아, 퍼옥시좀, 소포체, 핵등)에 분포해 있으며 FABP에 결합하여 지질합성, 세포의 구성 및 저장에 기여한다(Ye et al., 2022). 현재까지 알려진 12종류의 FABP은 동물의 종이나 같은 종에서도 조직에 따라 다양하게 발현된다(Wang et al., 2023). FAB3는 닭의 복부 지방 중량 및 복부지방률과 유의한 상관관계가 있어 육계의 복부지방 침착과 연관하여 육질 품질 향상을 위한 선택 지표 마커 유전자로 사용될 수 있다(Cui et al., 2018). 알을 낳는 산란계 형질의 관점에서, FABP3의 발현은 적은 알을 낳는 그룹보다 많은 알을 낳는 그룹에서 유의하게 더 높은 것으로 밝혀졌으며, 산란계의 FABP3는 알을 낳는 잠재적인 유전적 조절자로서 유전적 선발 마커로 이용될 수 있다(Wang et al., 2023).
닭의 근육 내 지방은 육질에 영향을 미치는 중요한 요소 중 하나이다. 지난 수십 년 동안 육계 사육은 주로 가슴살과 허벅지 살코기의 성장 속도와 육량을 높이는 데 중점을 두었다. 그러나 이러한 특성에서 이루어진 획기적 발전은 육계 고기의 맛 품질 저하와 일부 시장에서 소비자의 고기 선호도 감소를 동반하였다(Berri et al., 2001). 쇠고기와 비교하여 닭고기는 마블링이 없고 근육 내 지방이 보이지 않으며 해부학적으로 분리할 수 없다. 닭고기의 근육 내 지방 함량이 28일령에서 90일령까지 나이가 들면서 증가하며 그 이후(90—140일령) 고기의 풍미와 맛과 함께 더 증가할 수 있다(Sun et al., 2006; Chang et al., 2010). 근내 지방은 대부분 축종의 상피조직, 근주막 및 내막조직에 위치하며 육질의 중요한 결정 요인이다. 일정량의 근내 지방은 풍미, 육즙, 수분 보유력 및 부드러움과 같은 육질 특성을 향상시킬 수 있다(Fernandez et al., 1999). 또한 근내 지방은 드립 손실과 조리 손실을 줄임으로써 육질을 개선할 수 있다(Gerbens et al., 2001). Cui et al.(2012)은 닭가슴살에서 근내 지방 침착과 관련된 후보 유전자를 발굴하기 위해 빠르게 성장하는 품종과 느리게 성장하는 품종에 대해 cDNA 마이크로어레이 분석을 수행하였으며, 근내 지방 발달 과정에서 핵심적인 역할을 할 수 있는 잠재적 후보 유전자들(MYBPC1, CETP, GLTPD1,SNX4)을 제시하였다. 이유는 이 유전자들이 닭의 근내 지방 침착 관련 지질 대사 및 근육 발달 즉, 연령에 따른 지질 함량 또는 가슴근육 무게의 변화 패턴과 관련이 있기 때문이다(Cui et al., 2012). 이는 닭 가슴살, 근내 지방 침착이 지질 대사 및 근육 발달과 관련된 유전자들에 의해 조절될 수 있음을 보여 준다.
암탉에서 지단백질은 약 95%의 노른자 지질을 공급한다(Alvarenga et al., 2011). 따라서 산란계는 일정 수의 난을 지속적으로 생산할 경우, 배란(ovulation)을 하기 전에 많은 양의 지방을 난황에 축적해야 한다. 배아 성장에 필요한 구성 물질의 주요 원천은 난자 내 저장 공간인 난황이다. 이 난황에 지질의 비축은 난자의 성장 과정에서 혈장으로부터 대량의 물질분자를 침적시킴으로써 형성되며, 이 과정을 난황 생성(vitellogenesis)이라고 한다(Schneider, 1996). 난황에 있는 특정 유형의 지방과 지방구성 성분들은 estrogen과 progestrone의 조절을 받고 간에서 합성되어 난황전용 VLDLy(yolk-labelled VLDL)과 Vitellogenin(VTG)을 이용하여 혈관을 따라 난포(난소포막)로 이동하여 전달된다(Walzem, 1996). 닭 난모세포의 최종 급속 성장 단계는 간에서 합성된 난황 전구체 단백질들, 특히 앞의 두 가지 주요 난황 형성 성분(VLDLy, VTG)들을 혈장에서 대량으로 흡수하는 것이 특징이다. 이 성분들을 난황으로 유입하는 난황 지단백 수용체(VTG/VLDL receptor) 단백질은 돌연변이에 의해 산란을 못하는 암탉에는 존재하지 않으며, 따라서 VLDL과 VTG의 난황 축적도 일어나지 않는다(Nimpf et al., 1989). 수탉 또한 알을 낳지 않기 때문에 난황형성과 관련된 vitellogenin 유전자의 발현은 없다. 지질 인산형 단백질인 Vitellogenin은 알을 낳는 암탉의 유전자에 의해 간에서 생성되고, 난황형성과 알의 형성에 중요한 역할을 한다. 간은 VLDLy에서 중성지방과 인지질을 준비하고 분비하는데, 독특한 구조와 생화학적 특성을 가지고 있다(Walzem et al., 1999). 이 지단백질은 정상 VLDL보다 절반 정도 작으며, 표면에 VLDL-II 아포단백질을 가지고 있어서 조직 내 LPL에 잘 분해되지 않는 기질로, VLDLy의 중성지방은 근육이나 지방조직에서 잘 사용되지 않는다. 산란 닭에서 apoVLDL-II는 estrogen의 영향을 받아 합성되며, LPL의 특정 억제제로 작용하는 것으로 알려져 있다(Schneider et al., 1990). VLDLy의 작은 크기는 난소기저막/난소포막(granulosa basal lamina)을 통과하고 난황막(oolemma)에 있는 LR8 수용체에 결합할 수 있게 해주는데, 이후로는 완전한 형태로 수용체 매개 내포작용(endocytosis)으로 유입되어 노른자를 형성한다(Alvarenga et al., 2011). VTG는 매우 높은 밀도의 지단백질이며, 발달 중인 알에 운반되어 그곳에서 phosvitin과 lipovitellin, vitellin, phosvette 등으로 분해되는데, 이것들이 알의 노른자에 존재하는 단백질들이다(Gerber-Huber et al., 1987). 난소포막과 VLDLy, VTG의 크기 조합은 간에서 합성된 지질만이 노른자에 포함되도록 허용하여, 노른자의 지질 특성을 유지한다(Alvarenga et al., 2011). 그러나 사료로 공급되는 식이성 다중불포화지방산은 난황의 지질에 영향을 미치게 되는데, 노른자의 다중불포화지방산 함량은 공급되는 지방산의 섭취량과 양적으로 양의 상관관계를 가진다(Noblet et al., 1996). 조류를 포함하여 알을 낳는 종에게 있어서 VTG의 내포작용에 관여하는 난황막 VTG 수용체는 알의 성숙을 위한 중요한 단계를 조절하며 번식을 위해 중요한 역할을 한다. 성장하는 알의 표면에 있는 VTG 수용체는 VTG 및 기타 인식하는 리간드(ligand)들과 결합하여 알의 난황 내에 높은 농도로 축적할 수 있다. 닭 VTG 수용체는 VLDL, riboflavin-binding protein, α-2-macroglobulin 등을 성장 중인 알로 내포작용에 의해 유입시킨다(Schneider, 1996). 포유류는 젖 및 태반과의 공동진화를 통해 VTG 단백질의 점진적 소실이 있었다(Babin, 2008; Brawand et al., 2008). 포유류가 아닌 알을 낳는 척추동물에서는 배아 발달이 완전히 VTG 단백질에서 유래한 영양 비축물에 의존하지만, 포유류는 태반과 젖을 발달시켜 태아와 초기새끼에게 영양분을 공급한다. 닭 유전체에서는 두 개의 VTG (VTG2 및 VTG3) 유전자와 두 개의 유사유전자(pseudogene)가 염색체 8번의 앞뒤로 나란히 위치하며, VTG1은 같은 염색체의 다른 영역에 별도로 위치한다(Tian et al., 2010). 포유류에서 세 가지 VTG 유전자는 포유류가 진화하는 동안 점진적으로 기능을 잃고 유사유전자로 변화되었다(Babin, 2008; Brawand et al., 2008). 현재로서는 거의 모든 난황 구성 성분이 난자 외부에서 합성된다는 개념이 통용되고 있다. 순환계로 분비된 후 난황 전구체는 난자로 전달되어 난자 표면 수용체에 의해 인식되며 내포작용에 의해 유입된다. 수용체 매개 내포작용은 난황 구성 성분의 선택적이면서 효율적으로 흡수를 하여 난자성장을 조절한다.
가금에서 지방 대사 조절에 관한 연구는 인체나 설치류인 쥐에 비하여 활발하지 않다. 2000년 이전에 호르몬과 효소에 의한 지방대사 조절에 관한 연구가 주를 이루었다면, 그 이후에는 효소와 호르몬에 대한 유전자 수준에서의 발현 연구, 그리고 최근에는 지방합성 관련 유전체와 전사체 연구, 장내 미생물 균총 변화와 지방축적과의 상관성을 연구하는 분야로 그 범위가 크게 확대되고 있음을 볼 수 있다. 여기에서는 위에 열거한 연구들의 주요 내용을 간단히 소개하고자 한다. 육계에서 지방 대사의 관심은 지방의 축적에 있고 이와 연관된 주요 효소는 LPL, malate dehydrognease(MD), citrate lyase, fatty acid synthase(FAS), glycerol-3-phosphate dehydrogenase(G3PDH) 등이 있다. 앞에서 기술한 것처럼, 조류에서는 간이 지방생성 활동에서 지방조직보다 더 크다. 간은 내생 및 식이 유래 지방산에서 VLDL을 합성하고 혈류로 전달한다(Buyse and Decuypere, 2015). 따라서 지방조직에 축적되는 지방산은 대부분 리포단백질의 중성지방으로부터 유래하며, 이들 지방산은 지방세포의 지방구에 중성지방으로서 편입된다. LPL은 리포단백질에서 중성지방의 가수분해를 촉매하며, 이는 닭의 지방 조직에서 지질 축적의 속도 제한 단계에 작용하는 효소이다(Sato et al., 1999). 따라서 LPL의 활성 조절은 가금의 지방축적 조절의 주요한 한 요소가 될 수 있다. VLDL과 portomicron에서 중성지방이 지방 및 근육 조직으로 이동하는 것은 포유동물과 유사하며, insulin으로 활성화된 LPL의 참여를 포함한다. LPL은 주로 지방세포와 근육세포에서 합성되며, 혈관 벽 표면에 고정되어 insulin에 의해 활성화된다(Xu et al., 2010). Griffin et al.(1987)에 따르면, 닭에서 복부지방 축적과 LPL 활성 사이에 양의 상관관계가 있으며, 다른 연구자들 또한 절식 후 재급여를 한 경우 이 효소의 활성과 유전자 발현이 빠르게 증가함을 확인하였다(Smith and Pownall, 1983; Cooper et al., 1989). Hermier(1997)에 따르면, LPL 활성은 지방세포의 수와 관련되며, 개별 세포의 중성지방 저장 능력의 증가(hypertrophy)보다는 조직의 과성장(hyperplasia)을 반영한다. 따라서 복부지방을 기준으로 선택된 비만형 조류는 이러한 지방조직의 과성장을 나타낼 수 있다. 반면에 마른 체형의 조류에서는 LPL 활성이 지방조직보다 근육(심장을 포함한)에서 더 높게 발견되며, 이는 근육에서의 VLDL 중성지방이 저장보다는 산화를 위해 선호적으로 사용되기 때문이다(Griffin et al., 1992). 이러한 결과는 지방축적을 줄이는 육종을 위한 선발에서 지방세포의 수가 더 적은 계통을 확보하면 저지방 축적 닭으로 개량할 수 있을 것으로 추정할 수 있다. 그러나 이러한 경우에 LPL 활성의 결정은 적합한 기준이 되지 않을 수 있는데, 이 효소의 활성 표현이 일상적으로 실행되지 않을 수 있으며 생체검사 시료가 유기체 전체를 대표하지 못할 수 있기 때문이라고 한다(Hermier, 1997). 또한 Sato and Akiba(2002)에 의하면 육계에서 LPL mRNA 발현이 포유류에 비하여 연령이나 영양적 조절에 대해 덜 민감하게 반응하는 것도 LPL에 의한 육종 선발지표 선택의 한계로 볼 수 있다(Hermier et al., 1984). 육계가 부화 후 성장하는 동안 지방의 체내 부위별 축적은 성장률과 비례하여 증가하지 않는 것으로 보인다. Bai et al.(2015)의 연구에 의하면, 육계의 부위별 지방 조직의 성장률은 4일부터 14일까지 차이가 있었는데, 체중의 비율 기준으로 복부 지방에서 가장 큰 성장이 관찰되었고, 피하 지방에서는 가장 적었으며, 쇄골 지방에서는 중간 정도의 증가가 있었다고 한다. 상대적인 위치별 지방축적의 차이는 G3PDH 효소 활성의 변화와 일치하였으며, G3PDH는 세포의 해당과정 경로에 존재하는 dehydroxyacetone phosphate(DHAP)을 glycerol-3-phosphate(G3P)으로 역변환시키는 작용을 하는데, 이는 중성지방 합성 중 지방산 에스터화의 기반이 된다. G3PDH는 탄수화물 대사(해당과정)와 지질 대사(glycerol 생성) 간의 주요 연결 역할을 하는데, 지방조직에서 glycerol kinase 활성이 낮고 G3PDH를 통한 G3P 생성이 중성지방 합성의 주요 원천인 경우, G3PDH활성은 지방세포 최종 분화와 높은 상관관계가 있다고 한다(Swierczynski et al., 2003; Sledzinski et al., 2013). 부화 후 4일부터 14일까지 복부, 쇄골, 피하 지방에서 G3PDH는 각각 거의 3배, 2배, 2배 증가를 보였는데, 복부 지방조직에서 중성지방 합성과 축적의 증가로 이어졌음을 보여준다(Bai et al., 2015). 복부의 지방 저장소 무게와 G3PDH 활성의 증가는 지방세포 크기의 증가와 동시에 발생했으며, 따라서 부화 이후 4일부터 14일까지, 지방세포 확장은 아마도 세포 수 증가(과잉세포증)와 세포 크기 증가(과비대증)의 조합으로 지원되었을 것으로 보인다. 부화초기 병아리와 4주령에 G3PDH 활동의 조직 분포조사(지방조직, 뇌하수체, 간 및 골격 근육)에서 다른 조직보다 지방에서 높았다고 한다(Garcia-Solis et al., 2002; Bai et al., 2015). 그러나 이후 주령 닭에서는 간에서 다른 조직보다 상대적으로 높은 활동이 있었다. 따라서 이 효소의 활동에는 중성 지방의 합성 및 저장 능력에 연령에 따른 차이가 있는 것으로 보인다. 조류에서 간은 지방생성의 대부분을 책임지기 때문에 간 내 지방산 합성이 증가하면 VLDL의 분비량이 증가한다. Whitehead and Griffin(1984)에 의하면 성장하는 조류에서 지방생성에 관여하는 주요 효소인 MD와 citrate lyase의 활성이 복부 지방의 무게로 평가된 고기의 지방도와 양의 상관관계(0.4~0.5)를 보였다. 또한 비만형 조류에서 간 내 지방산 합성에 관여하는 효소의 활성이 증가하며, 근육형 동물들과 비교하여 더 높은 혈장 VLDL값을 나타냈다(Bannister et al., 1984; Leclercq et al., 1990). 이러한 결과는 적어도 부분적으로 간 내 지방생성의 증가로 인해 비만의 결과가 발생한다는 것을 시사한다.
최근 연구에 의하면, 지방생성과 지방축적에 장(gut)-간(liver) 축과 장내 미생물균총이 관여한다는 증거가 늘어나고 있다. 장-간축에 대한 연구는 고지방 사료 급이로 비만이 유도된 닭을 이용하여 닭의 지방생성조절과 관련된 장-간의 상호 연결를 확인하기 위하여 대사체학과 전사체학을 사용한 경우이다(Chen et al., 2023). 닭에서 고지방 식이로 유발된 과도한 지방생성에 대한 반응으로 간과 맹장의 대사 정보의 변화를 확인하고, 이에 따른 주요 대사 산물과 유전자의 상관 분석을 실시하였다. 결과는 식이 중의 특정 대사산물 지방산(5-hydroxyisourate, alpha-linolenic acid, bovinic acid, linoleic acid 등)이 장과 간 사이의 신호 분자로 작용하여 간에서 ACSS2, PCSK9, CYP2C18의 발현을 촉진하고 CDS1, ST8SIA6, LOC415787, MOGAT1, PLIN1, LOC423719, EDN2 중 하나 이상의 유전자를 억제하여 닭의 지질합성을 촉진할 수 있다고 한다. 더 나아가, 대사산물 taurocholic acid은 장에서 간으로 운반되어 ACC1, FASN, AACS, LPL의 발현을 조절하여 고지방 식이로 인한 지질합성에 기여한다고 하였다. 육계의 십이지장과 맹장 등의 장내 미생물 군총의 16S rRNA 유전자 서열분석과 복부 지방축적과의 관계를 조사한 결과 장내 미생물 균총의 변화는 지방축적에 큰 영향을 미친다고 한다(Wen et al., 2019). 또 다른 연구에서, 닭에게 3주간 항생제를 투여하여 장내 미생물을 제거하면 혈청 중성지방, LDL 및 간의 중성지방 등이 모두 증가한다(Zhang et al., 2021). 즉, 장기간의 항생제 치료가 닭의 지방생성을 크게 촉진할 수 있음을 보여 주었다. 위의 두 연구 사례에서 보듯이 장내 미생물군이 닭의 지방생성과 지방축적에 조절자로서 중요한 역할을 할 수 있음을 보여 준다. 최근 단쇄 지방산(short chain fatty acids, SCFA: acetate, propionate, and butyrate)과 같은 미생물 유래 대사물질이 지방조직을 포함한 장(소화기관) 이외의 기관에 영향을 미쳐 숙주동물(생쥐, 사람 등)에 이점을 제공한다는 것을 보여주고 있다(May and den Hartigh, 2021). 조류인 닭과 포유류의 장내 환경과 차이는 있겠지만 가금분야에서 장 미생물 유래 대사물질인 SCFA와 지방합성과 분해 및 조절에 어떤 영향을 미칠 수 있는지 이해하기 위한 새로운 연구 시도가 기대된다. 중성지방 함량은 가금류 근육 내의 지방 축적에 매우 중요하며 고기 품질에 많은 영향을 미친다. 닭의 유전체 연구(GWAS: genome-wide association study)를 통해 확인된 중성지방의 대사에 영향을 미치는 특정 후보 유전자 발굴(예, SLC16A7)은 닭 근육조직의 중성지방 축적을 촉진하는 유전자로서, 지방산 합성, 지방산 사슬 신장, 지방산불포화, 지방산수송 등과 연관된 ACSL5, ELOV5, FABP5, PPARG, RXRG 등과 공동 발현되며, 주로 근세포에서 조직 특이적으로 발현된다(Bosshart et al., 2019; Wang et al., 2022). SLC16A7은 지방 신생성을 통해 근육 세포 내에서 중성지방 축적에 영향을 미칠 수 있는 것으로 보이며, 근육 내 지방 생성의 분자생물학적 조절자로서 가능성을 보여주고 있다(Wang et al., 2022). 이러한 연구들(지방합성, 미생물 균총, GWAS 등)은 전통적 닭의 지방합성에 관한 연구 방법에서 벗어나 지방합성과 조절에 대한 이해를 높이기 위한 중요한 시도로 평가된다.
결 론
닭의 지방대사에 대한 연구는 닭의 생리적 측면에 대한 이해를 높이기 위한 연구가 주를 이루었다고 할 수 있다. 그러나 현대 양계에서 볼 수 있듯이 육계는 성장률과 고기생산에 집중한 육종으로 복부지방의 축적으로 소비자들에게 부정적 영향을 주었다. 산란계는 높은 산란율과 지속적 난생산을 위한 육종으로 난황생성에 필요한 많은 양의 지방을 난황에 축적해야 한다. 이러한 시대적 변화에 따라 닭의 지방대사에 대한 이해뿐만 아니라 그 조절에 대한 연구와 사육 현장에서의 적용이 중요한 시점이라 할 수 있다. 닭의 유전체 연구와 지방대사 연관 유전자들의 발굴, 장내미생물균총 변화와 지방 합성 및 분해에 대한 최근의 연구 시도는 지방대사 조절을 위한 새로운 접근으로 그 의미가 크다고 할 수 있다.








